Stefan Brunzel und Benjamin T. Hill
Zusammenfassung
Die Intensivierung der Landnutzung und der Klimawandel haben zu einem großen Teil synergistisch wirkende negative Effekte auf Lebensräume und Artengemeinschaften. Davon sind auch Lebensraumtypen (LRT) und Arten der Fauna-Flora-Habitat-Richtlinie (FFH-RL) der EU betroffen. Wenn
sich der Erhaltungszustand der LRT und Arten der FFH-RL verschlechtert, sind Gegenmaßnahmen zu ergreifen. Damit die Maßnahmen zielgerichtet konzipiert und Prioritäten für diese abgeleitet werden können, ist es erforderlich, Klimawandel und Nutzungsintensivierung als Ursachen getrennt
zu beurteilen. Negative, überwiegend klimawandelinduzierte Entwicklungen sind dabei in vielen Fällen mit den herkömmlichen Naturschutzinstrumenten kaum aufzuhalten. Deshalb müssen etablierte Naturschutzinstrumente überdacht und auch die FFH-RL muss ggf. flexibilisiert werden. Schon
vorhandenes Wissen aus der Forschung muss evidenzbasiert in neu konzipierten Managementmaßnahmen schnellstmöglich umgesetzt werden und dort, wo noch Wissen fehlt, müssen hypothesenbasiert neu konzipierte Managementmaßnahmen erprobt werden. Der vorliegende Beitrag adressiert anhand von
Fallbeispielen klimawandelinduzierte Probleme in der FFH-RL und stellt für diese Probleme evidenz- und hypothesenbasiert an den Klimawandel angepasste Maßnahmenkonzepte zur Diskussion.
Klimawandel – FFH-Richtlinie – klimawandelinduzierte Veränderungen – klimawandelangepasstes Management – MaßnahmenpriorisierungAbstract
Land-use intensification and climate change have largely synergistic negative effects on habitats and species communities. Habitat types and species listed under the Habitats Directive of the EU are also affected. If their conservation status deteriorates, countermeasures must be
taken. In order to design and prioritise these measures properly, it is vital to assess climate change and land-use intensification separately as causes of such deterioration. Negative, predominantly climate change-induced developments can in many cases scarcely be halted by means of
conventional nature conservation instruments. Therefore, established conservation instruments need to be reconsidered and the Habitats Directive must also be made more flexible wherever this is necessary. Based on evidence, existing knowledge from research needs to be integrated into
newly designed management measures and implemented as quickly as possible, and where knowledge is still lacking, new hypothesis-based management measures have to be tested. This article addresses, by means of case studies, a range of climate change-induced issues concerning the
Habitats Directive regime and goes on to present for discussion evidence- and hypothesis-based concepts for measures that are adapted to climate change.
Climate change – Habitats Directive – Climate change-induced alterations – Climate change-adapted management – Prioritisation of measuresInhalt
1 Einleitung
Die Intensivierung der Landnutzungen und der Klimawandel verstärken sich in ihren jeweiligen negativen Auswirkungen auf Lebensräume und Artengemeinschaften (Frishkoff et al. 2016; Guo et al.
2018; Seibold et al. 2019; Halsch et al. 2021). Davon sind natürlich auch Lebensraumtypen (LRT) des Anhangs I und streng geschützte Arten der Anhänge II
und IV der Fauna-Flora-Habitat-Richtlinie (FFH-RL) betroffen; die Erhaltung der LRT und Arten müssen die Mitgliedstaaten der EU und damit auch die deutschen Bundesländer regelmäßig im Rahmen des FFH-Monitorings erfassen und bewerten (Ellwanger,
Ssymank 2012; Streitberger et al. 2016; BfN, BLAK 2017a, b). Wenn sich der Erhaltungszustand der Arten oder LRT der Anhänge verschlechtert,
sind Gegenmaßnahmen zu ergreifen. Hierzu wäre es erforderlich, die Ursachen Klimawandel und fortdauernde Nutzungsintensivierung getrennt beurteilen zu können, um daran angepasst Priorisierungen für Maßnahmen abzuleiten. Die Erkenntnis ist nicht neu, wird aber durch den Einfluss
klimatischer Veränderungen um ein Vielfaches deutlicher: Etablierte Naturschutzinstrumente, allen voran auch die FFH-RL, müssen überdacht und flexibilisiert werden (vgl. Altmoos, Burkhardt 2016). Schon vorhandenes Wissen aus der Forschung muss
im Sinne einer „Ökologisierung des Arten- und Biotopschutzes“ (Krüß et al. 2016) evidenzbasiert in neu konzipierten Managementmaßnahmen schnellstmöglich umgesetzt werden. Dort, wo noch Wissen fehlt, müssen hypothesenbasiert neu
konzipierte Managementmaßnahmen ausprobiert werden, deren Auswirkungen solide zu monitoren sind. Auf dieser Basis müssen dann bisherige Nutzungen und Managementmaßnahmen angepasst werden.
Der vorliegende Beitrag adressiert anhand von Fallbeispielen durch den Klimawandel induzierte und verstärkte Probleme im Bereich von Natura 2000 (Regelungen der FFH-RL und der Vogelschutzrichtlinie – VS-RL) und stellt für diese Probleme evidenz- und hypothesenbasiert
an den Klimawandel angepasste Maßnahmenkonzepte zur Diskussion.
2 Flexibilisierte Maßnahmen- und Nutzungstermine für FFH-Arten und FFH-LRT
2.1 Anpassung von Nutzungsterminen in Naturschutzprogrammen an klimatische Veränderungen
Verschiedene Studien belegen, dass seit Anfang der 1980er-Jahre die Phänologie von Arten und Lebensgemeinschaften eine Verfrühung um im Mittel ca. 4 Tage pro Jahrzehnt erfahren hat (Peñuelas et al. 2009; Rumpf et al. 2018). Schon 2003 (!) wurde auf einer Tagung des Bundesamtes für Naturschutz (BfN) gezeigt, dass sich im Zeitraum zwischen 1951 und 2001 für die Vollblüte des Wiesen-Fuchsschwanzes(Alopecurus pratensis) eine
Verfrühung um ca. 10 Tage ergeben hat (Abb. 1; Wieden 2003). Durch Extrapolieren der Trendlinie in Abb. 1 ergibt sich, dass seit den
1980er-Jahren bis heute eine Verfrühung der Gräservollblüte um ungefähr 15 Tage stattgefunden hat und damit eine Verfrühung des Zeitpunkts mit dem höchsten Nähstoffgehalt in der Grasbiomasse einhergegangen ist. Deshalb müsste der für den Nährstoffgehalt des Mähguts günstigste
Zeitpunkt des Wiesenschnitts jetzt in der 2. bis 3. Maiwoche liegen.
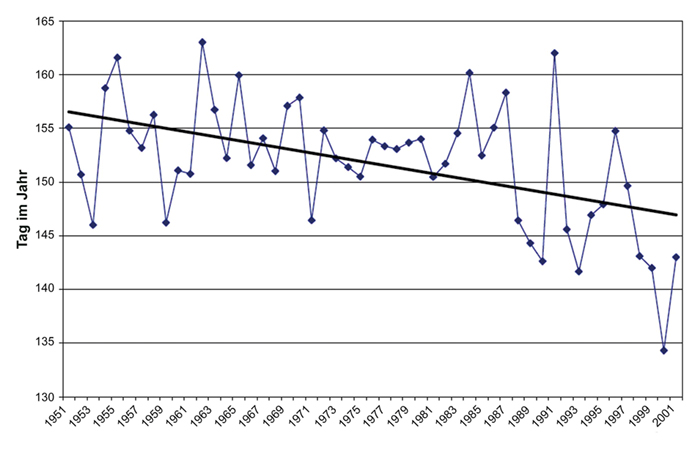
Abb. 1: Veränderung des Beginns der Vollblüte des Wiesen-Fuchsschwanzes(Alopecurus pratensis) in den Jahren 1951 – 2001 in Deutschland. Blaue Linie: jährliche Mittelwerte, schwarze Linie: linearer Trend .
Fig. 1: Change in the onset of full flowering of meadow foxtail (Alopecurus pratensis) in the years 1951 – 2001 in Germany. Blue line: annual mean values, black line: linear trend .
(verändert aus Wieden 2003, Daten: DWD 2003)(modified from Wieden 2003, data: DWD 2003)
In den Naturschutz- und Kulturlandschaftsprogrammen für eine naturschutzkonforme, extensive Landwirtschaft, die zur Umsetzung der Naturschutzziele auch in Hinblick auf Natura 2000 sehr wichtig sind, bilden alle vorgeschriebenen Nutzungstermine – nach Bundesländern in
unterschiedlichem Ausmaß – aber ungefähr noch die späten 1980er-Jahre ab. So gab es beispielsweise in den u. g. Bundesländern im Jahr 2020 folgende vorgeschriebene Mahdtermine:
● Nordrhein-Westfalen (seit 2010) für Mahd: bis 200 m ü. NN 1.6., bis 400 m 15.6., über 400 m 1.7. (Abweichungen von +/− 5 Tagen werden toleriert);
● Hessen (Hessisches Programm für Agrarumwelt- und Landschaftspflegemaßnahmen – HALM seit 2015): Extensivgrünland generell 1.5. bis 30.9., bei naturschutzfachlich besonders wertvollem NSL-Grünland (NSL = naturschutzfachliche Sonderleistungen) ist die
erste Mahd aber frühestens ab 1.6. oder 1.7. möglich; ● Thüringen (seit 2014) für Mahd: generell 21.6. oder 21.7., aber abweichendes Regime grundsätzlich möglich (mit „Schonfläche“ oder Ruhephase), dann vor dem 1.6. bzw. 15.6.
Die Termine für naturschutzkonforme Beweidung liegen in den gängigen Naturschutzprogrammen i. d. R. früher, teilweise schon am 15.4., was angesichts der phänologischen Verfrühung des einsetzenden Gräseraustriebs aber ebenfalls noch früher sein könnte. Eine frühere
Nutzung vor diesen Terminen ist für die Landbewirtschafterin bzw. den Landbewirtschafter generell nicht möglich, da dies im Sinne der Förderrichtlinien ein „anlastungsfähiges“ Vergehen wäre mit der Folge der Prämienrückzahlung.
Eine Anpassung bzw. Flexibilisierung der Nutzungstermine wurde bereits von Wieden (2003) vorgeschlagen. Modifizierte Termine wurden in einigen Projekten zur naturschutzkonformen Grünlandnutzung auch berücksichtigt, bis heute fanden diese
aber in den Richtlinien zu den Naturschutzprogrammen der Bundesländer kaum Beachtung. Ein durch den Klimawandel nochmal dringlicher gewordenes angepasstes Maßnahmenkonzept sähe wie folgt aus (die nicht in der Online-Ausgabe, aber in der gedruckten Ausgabe und in der
PDF-Datei farbig hinterlegten Textbereiche geben jeweils unsere Position wieder):
Ein sehr früher Beweidungs- oder Mahdtermin liegt vor dem 15.4., gefolgt von einem für die meisten Arten ausreichenden phänologischen „Reproduktionsfenster“, das auch die wachsende Problematik klimawandelbedingter Sommerdürren mildern könnte. An das Reproduktionsfenster
(nutzungsfreier Zeitraum) schließt sich dann eine „Nach“-Beweidung oder Mahd ab dem 31.7. bis Ende November an. Darüber hinaus kann die Fläche außerhalb des Reproduktionsfensters zu jeder aus Sicht der Nutzerin bzw. des Nutzers wirtschaftlich sinnvollen Zeit zusätzlich genutzt werden.
Das angepasste Konzept würde sowohl der klimatisch bedingten Verfrühung als auch einem erhöhten Nährstoffeintrag in Systeme Rechnung tragen. Wo es wirtschaftlich und administrativ für Nutzerinnen und Nutzer möglich oder zumutbar ist, wäre auch ein raum-zeitversetztes „mosaikartiges“
Nutzungsmuster zielführend, solange durch die temporäre Nicht-Nutzung einzelner (Teil)flächen keine Verbrachungserscheinungen auftreten. Hierbei ist jedoch auch zu bedenken, dass ein temporärer Nutzungsverzicht von (Teil)flächen in den meisten Naturschutzprogrammen der 2. Säule
der EU-Agrarförderung nicht möglich ist.
Die konkreten Auswirkungen eines solchen an den Klimawandel angepassten Nutzungsregimes sind unseres Wissens nach bisher kaum untersucht und müssten in bestimmten Fällen noch evaluiert werden. In Hinblick auf wenige sehr früh blühende, wertgebende Arten des mageren Grünlands,
z. B. Kleines Knabenkraut (Orchis morio), könnten hier negative Effekte eintreten, sodass diese evtl. fallbezogen berücksichtigt werden müssten. Es ist zu erwarten, dass sich die Lebensgemeinschaften durch das angepasste Nutzungsregime ändern werden und man sich von starren
typischen Ausprägungen vegetationskundlich basierter LRT verabschieden muss. Auf Basis von Expertenwissen und aufgrund forschungsbasierter Hypothesen, die häufig auf nicht publizierten Praxiserfahrungen mit großflächigen Beweidungssystemen (Bunzel-Drüke
et al. 2019; Bluth et al. 2020) oder speziell mit Pflegemaßnahmen, die an einzelne Arten angepasst sind (vgl. Dolek et al. 2009; Brunzel et al. 2017), beruhen, ist jedoch anzunehmen, dass durch ein derartiges an den Klimawandel angepasstes Nutzungsregime die meisten (Ziel)arten in den jeweiligen Gemeinschaften gehalten werden könnten – ohne die Flexibilisierung
von Terminen jedoch wahrscheinlich nicht.
2.2 Anpassung durch räumliche und mikroklimatische Habitat-Diversifizierung und Habitat-„Überoptimierung“
Viele Arten und Lebensgemeinschaften lassen sich grob in „Klimagewinner“ und „Klimaverlierer“ unterteilen (vgl. Streitberger et al. 2016; Schwenkmezger 2019). Über alle Organismengruppen
hinweg reagieren einige Arten negativ auf klimatische Veränderungen und ziehen sich – für Mitteleuropa vereinfacht gesagt – nach Norden oder in Hochlagen zurück oder sterben lokal aus, wenn ihnen ein Rückzug nicht möglich ist (Parmesan, Yohe
2003; Bässler et al. 2013). Beispiele für Arten, die stark oder überwiegend unter dem Klimawandel leiden, sind Pflanzen wie Berg-Wohlverleih (Arnica montana), montane Tagfalterarten der Gattung Erebia, Libellen
der Moore wie die Schwarze Heidelibelle (Sympetrum danae) oder bestimmte Moosjungfer-Arten (Leucorrhinia dubia, L. rubicunda) (Settele et al. 2008; Stanik et al. 2018;
Schwenkmezger 2019; Reinhardt et al. 2020; Titze et al. 2020; Adelmann, von Blanckenhagen 2021).
Andere Arten wie die Südliche Heidelibelle (Sympetrum meridionale), die Südliche Mosaikjungfer (Aeshna affinis), der Karst-Weißling (Pieris mannii) und der Kurzschwänzige Bläuling (Cupido argiades) werden häufiger, wandern aus wärmeren Klimaten ein (Schiel, Kunz 2005; Reinhardt et al. 2020) und breiten sich nach Norden aus (Parmesan, Yohe 2003; Zeuss
et al. 2014).
Viele klimasensitive Arten wechseln aufgrund klimatischer Veränderungen aber auch innerhalb einer Region ihre angestammten Habitate oder ändern innerhalb einer lokalen Population ihre Ansprüche und Lebensweisen in einem bestimmten Lebensraum, z. B. durch Wechsel der
Nahrungspräferenzen, durch Änderung von Verhaltensweisen oder durch Wechsel mikro- und mesoklimatischer Präferenzen im Habitat – sofern dieses groß genug ist (Preston et al. 2008; Forister
et al. 2010; Pateman et al. 2012). Das kann bedeuten, dass sie sich aus den offenen Magerrasen in stärker verbuschte Bereiche zurückziehen (Davies et al.
2006; Oliver et al. 2009; Laussmann et al. 2010) oder innerhalb eines räumlichen Verbunds geeigneter Habitate in z. B. höhere Lagen ausweichen (Bässler et al. 2013; Guo et al. 2018). In den hessischen Mittelgebirgen fand man etwa vor allem in den extrem trockenen Jahren von 2018 bis 2020 Pflanzenarten, die typisch und wertgebend für Magerrasen sind –
z. B. Fliegen-Ragwurz (Ophrys insectifera), Einknolllige Honigorchis (Herminium monorchis), Deutscher Fransenenzian (Gentianella germanica), Feld-Enzian (G. campestris) und Berg-Wohlverleih (zu den beiden letzten Arten siehe Kasten 1) – in ihren bisherigen Habitaten nur noch unter Bäumen, auf nordexponierten Flächen oder in Bereichen mit tiefgründigeren Böden und erhöhter Wasserkapazität (vgl. Brunzel 2011, 2012; Brunzel et al. 2017; Hollmann et al. 2020; Titze et al. 2020). Einige der genannten Arten sind
auch „offiziell“ als Klimaverlierer eingestuft (Streitberger et al. 2016; Schwenkmezger 2019).
Kasten 1: Feld-Enzian (Gentianella campestris) und Berg-Wohlverleih (Arnica montana) in Hessen.
Box 1: Field gentian (Gentianella campestris) and mountain arnica (Arnica montana) in Hesse.
Der Feld-Enzian kommt in Hessen aktuell nur noch an drei Standorten vor (Brunzel 2011, 2012; mündliche Mitteilung von Jan Milosch 2021). An einem Standort in Nordhessen wächst die Art innerhalb
eines Kalk-Magerrasens auf einem nordexponierten Hang auf einer tiefgründigen ehemaligen Ackerterrasse. Die beiden anderen Standorte liegen in Mittelhessen in Schutzgebieten im Lahn-Dill-Bergland auf sauren bis leicht basischen Magerrasen. In beiden Gebieten war die Art noch in den
1990er-Jahren auf größeren Flächen innerhalb dieser Magerrasen zu finden. Seit den Jahren 2006 – 2010 kommt sie an beiden Standorten nur noch in von Bäumen teilweise beschatteten Bereichen vor (Abb. K1-1). Darüber hinaus liegen alle ehemaligen erloschenen Populationen in Hessen in niedrigeren Lagen (Brunzel 2011).

Abb. K1-1: Rückzug von zwei der drei Populationen des Feld-Enzians (Gentianella campestris) in Mittelhessen aus offenen Magerrasenflächen in halbschattigere Bereiche im Schutz von Bäumen: a) Standort „Dimberg“, im kleinen Bild
Ansicht der besiedelten Flächen von Norden; b) Standort „Wommelshausen“, im kleinen Bild Ansicht der besiedelten Fläche von Süden. Die Bestände der dritten Population (nicht abgebildet) wachsen nur noch auf einer nordexponierten ehemaligen Ackerterrasse innerhalb eines größeren
Kalkmagerrasens. )
Fig. K1-1: Withdrawal of two of the three populations of the field gentian (Gentianella campestris) in Central Hesse from open parts of nutrient-poor grasslands into semi-shaded areas protected by trees: a) Dimberg site, small picture: view of the
habitat from north, b) Wommelshausen site, small picture: view of the habitat from south. The plants of the third population (not illustrated) now grow only on a north-facing former field terrace within a larger calcareous nutrient-poor grassland.
(Luftbilder: Google Earth, Fotos: Stefan Brunzel
Ähnliches lässt sich auch für den Berg-Wohlverleih in Hessen beobachten: Die Tiefland-Vorkommen unter 500 m ü. NN zeigen die stärksten Rückgänge oder sind schon erloschen. Vor dem Hintergrund der klimatischen Veränderungen besteht für die
Tiefland-Populationen von Arnica montana in Hessen nur in feuchten Borstgrasrasen die Chance auf Fortbestand der Populationen (Schwenkmezger 2019; Titze et al. 2020).
Als an den Klimawandel angepasste Maßnahmenkonzepte könnten hieraus folgen:
Schaffung großflächiger räumlich-funktionaler Verbünde von Habitaten und Metapopulationen. Als Naturschutzkonzept ist dies grundsätzlich nicht neu (vgl. Kaule 1986; Plachter 1991), jedoch ist dies
in konkreter Form dringlicher denn je. Bestehende Populationen und Vorkommen klimasensitiver Arten und FFH-LRT sollten „überoptimiert“ und mikro- und mesoklimatisch diversifiziert werden. Eine „Überoptimierung“ zielt auf eine Vergrößerung der Population ab, die stabiler und adaptiver mit
Veränderungen umgehen kann. Dies kann vor allem durch Verbesserung der aktuell genutzten Schlüsselressourcen (z. B. Größe der Futterpflanzenpopulation, Menge geeigneter Reviere, Balz-/Eiablageplätze) geschehen. Eine zur Stabilität beitragende Diversifizierung des Habitats gelingt
vor allem durch eine drastische Erweiterung der Kernhabitate um aktuell suboptimale angrenzende Potenzialflächen. Hier bedeutet dies hinsichtlich einer mikro-/mesoklimatischen Diversifizierung (Pufferung) z. B., dass nord(ost)exponierte Flächen einbezogen werden und dass
insbesondere in Kalkmagerrasen-LRT einzelne Bäume oder wenig ausbreitungsfreudige Gebüsche – kein Schlehdorn (Prunus spinosa)! – bei Maßnahmen stehengelassen werden. Es bedeutet aber auch, Waldweide- und Mittelwaldnutzungen zu etablieren, die in räumlich-funktionalem
Zusammenhang zu Offenland stehen und als Rückzugsorte für Offenland- oder Saumarten („Lichtwaldarten“) dienen können.
Die genannten an den Klimawandel angepassten Maßnahmen sollten natürlich in Bezug auf Klimaverlierer (FFH-Arten und FFH-LRT) prioritär für Räume konzipiert werden, die auf Basis von z. B. Artverbreitungsmodellen (Species-Distribution-Models, siehe Abschnitt 3) auch unter künftigen klimatischen Bedingungen für die jeweiligen Ziel-Arten noch geeignet wären (z. B. Hochlagen der Mittelgebirge etc.; vgl. auch Schwenkmezger 2019).
3 Priorisierung und Flexibilisierung der Ziele und Evaluationsinstrumente
Eine grobe Unterteilung in Klimagewinner und Klimaverlierer gilt natürlich auch für Arten der Roten Liste und der Anhänge der FFH-RL, vermutlich trifft dies auch für ganze LRT der FFH-RL zu (Petermann et al. 2007; Bittner et al. 2011). Schlumprecht et al. (2010) und Fartmann et al. (2012) schätzen, dass ein großer Teil der Arten der FFH-Anhänge in
Deutschland negativ durch klimatische Veränderungen beeinflusst wird (vgl. auch Streitberger et al. 2016). In den letzten Jahren wurden in der makroökologischen Wissenschaft auf statistisch valider Basis Artverbreitungsmodelle
(Species-Distribution-Models – SDM) entwickelt und getestet, die es in hoher räumlicher Auflösung (< 1 km²) erlauben, die künftige Verbreitung der jeweiligen Arten unter den vom Weltklimarat(IPCC) prognostizierten Klimawandelszenarien auf der Basis einer für einen
konkreten Raum berechneten künftigen Antreffwahrscheinlichkeit der Arten vorherzusagen (vgl. u. a. Hanspach et al. 2013; Steger 2021). Selbstverständlich spielen neben klimatischen
Parametern auch die Landnutzung und daraus resultierende Faktoren wie z. B. Habitatstruktur/-qualität eine mitentscheidende Rolle für die Antreffwahrscheinlichkeit von Arten. Doch wäre hinsichtlich des Schutzes und Managements von FFH-Arten und FFH-LRT die Identifikation von Räumen, in
denen in Zukunft wahrscheinlich klimatisch ungünstige Bedingungen herrschen werden, schon ein wichtiger Schritt zur Priorisierung von Maßnahmen. Darüber hinaus können auch habitatstrukturelle Parameter, die z. B. aus LIDAR-Daten (light detection and ranging) abgeleitet werden
können, mittlerweile problemlos in diese Modelle eingebaut werden (vgl. u. a. Steger 2021).
Für viele FFH-Arten und FFH-LRT existiert dieses Werkzeug nur rudimentär (nicht auf Basis von SDM). Hier besteht konkreter Bedarf, denn für Arten der FFH-Anhänge und der Roten Liste sollten entsprechend SDM entwickelt werden. Auch bei der Bewertung negativer Veränderungen von
FFH-Arten und FFH-LRT könnten SDM genutzt werden, um künftig den weiterhin bestehenden negativen Einfluss durch die Landwirtschaft von den Bestandsrückgängen aufgrund rein klimatischer Veränderungen trennen zu können.
Auch wenn sie nicht als alleiniges Entscheidungskriterium für Maßnahmenkonzepte des Naturschutzes ausreichen, sollten SDMs insbesondere in Kombination mit Experteneinschätzungen die Grundlage für die Priorisierung von Maßnahmen für FFH-Arten und FFH-LRT liefern, aber auch zur
Gefährdungseinschätzung dienen. Dies ist in ersten Schritten bereits geschehen, z. B. in Hessen mit der „Liste potentieller Klimaverlierer“ (Schwenkmezger 2019). In Hinblick auf eine Anpassung von Naturschutzinstrumenten wie der FFH-RL
und daraus resultierender Konzepte ergeben sich folgende veränderte an den Klimawandel angepasste Strategien und Maßnahmen:
Im Sinne einer an den Klimawandel angepassten Priorisierung von Maßnahmen und Konzepten sollte der Fokus auf Klimaverlierern (FFH-Arten und FFH-LRT) liegen, und zwar in Räumen, wo deren Fortbestand unter moderaten Klimawandelszenarien auch künftig noch wahrscheinlich ist.
Beispielhaft wären hier bei den Lebensräumen Bachläufe der Mittelgebirge, alle Quellen, Vermoorungen sowie Feuchtwiesen und ihre jeweiligen Arten zu nennen (vgl. Ellwanger, Ssymank 2012; Streitberger
et al. 2016; Schwenkmezger 2019). Vor dem Hintergrund klimatischer Veränderungen sind insbesondere Quellen und Bachläufe sehr bedeutsam, weil sie als Rückzugsräume für durch den Klimawandel besonders gefährdete
Artengemeinschaften dienen; deshalb sollten in einem ersten Schritt z. B. konsequent alle Quellen in einen möglichst naturnahen Zustand versetzt werden. Das Austrocknen von Quellbereichen und Bachoberläufen in den Mittelgebirgen in den Jahren von 2018 bis 2020, z. B. auch
im Nationalpark Kellerwald-Edersee, lässt zusätzlich stark negative Auswirkungen auf gefährdete Arten wie die Gestreifte Quelljungfer (Cordulegaster bidentata), die Zweigestreifte Quelljungfer (C. boltonii) oder den Feuersalamander (Salamandra salamandra) erwarten.
Auch Moorrenaturierungen kommt aus vielerlei Gründen eine prioritäre Bedeutung zu – selbstverständlich nur dort, wo die Erhaltung von Mooren trotz klimatischer Veränderungen auch künftig möglich erscheint bzw. unabhängig vom Vorkommen bestimmter Arten noch sinnvoll ist
(s. u.).
Auf Basis von SDM berechnete künftige Klimanischen können aber auch darauf hinweisen, dass Maßnahmen für Arten in bestimmten Räumen in Zukunft nicht mehr zielführend sind: So wäre beispielsweise der Sinn von Naturschutzmaßnahmen für Berg-Wohlverleih in süd- und
mitteldeutschen Tieflagen zumindest kritisch zu prüfen (siehe Abschnitt 2.2).
Hinsichtlich des Monitorings und der Trendevaluation von Klimaverlierern (FFH-LRT und FFH-Arten) besteht vielleicht der größte Anpassungsbedarf von Natura 2000 und damit verbundener Instrumente (vgl. Ellwanger, Ssymank 2012; Altmoos, Burkhardt 2016) darin, wie der Erhaltungszustand und negative Trends klima-sensitiver FFH-Arten und FFH-LRT künftig bewertet werden sollen, wenn negative Entwicklungen zum überwiegenden Teil auf klimatische Veränderungen zurückzuführen sind.
Wäre eine Moorrenaturierung auch dann erfolgreich, wenn aus klimatischen Gründen der Hochmoorcharakter inklusive der charakteristischen Arten verloren geht, aber der Wasserhaushalt wiederhergestellt ist? Ist der LRT 9150 „Orchideen-Buchenwald“ aufgrund der Krautschicht auch dann
noch vorhanden, wenn die Buchen anlässlich klimawandelinduzierter Dürren großflächig aus den Beständen verschwunden sind?
Negative Trends und Verschlechterungen bei Arten und LRT der FFH-RL können überwiegend durch klimatische Veränderungen induziert werden oder sie werden überwiegend durch die fortdauernde Landnutzungsintensivierung verursacht – in vielen Fällen wirken aber beide Ursachen
zusammen. Um aber diese unterschiedlichen Treiber negativer Trends voneinander trennen zu können, sind für Natura 2000 und hierbei vor allem für die FFH-RL neue Evaluationskriterien zu definieren und die Messinstrumente z. B. beim Monitoring des Erhaltungszustands
entsprechend anzupassen (vgl. Altmoos, Burkhardt 2016). Dies kann zum einen bedeuten, nicht klimawandelsensitive Indikatoren stärker zu berücksichtigen. Zum anderen sollten bspw. Entwicklungstrends von FFH-Anhangsarten in Populationen, in denen
Naturschutzmaßnahmen durchgeführt werden, von solchen getrennt analysiert werden, in denen bisher keine Maßnahmen durchgeführt wurden („Kontrollgruppe“). Auf diese Weise könnte der von klimatischen Veränderungen unabhängige Einfluss von Naturschutzmaßnahmen evaluiert werden. Dies ist
leider beim Design des FFH-Monitorings in der Vergangenheit verpasst worden.
4 Priorisierung von Naturschutzmaßnahmen: Konsequenzen für den speziellen Artenschutz
Aus der Priorisierung von Naturschutzmaßnahmen in Hinblick auf die FFH-RL und VS-RL kann sich ergeben, dass bisherige Mittel aus der im speziellen Artenschutz nach § 44 Bundesnaturschutzgesetz (BNatSchG) anfallenden Kompensation – z. B. CEF-Maßnahmen
(continous ecological functionality) – umgeleitet werden sollten. Ist es vor dem Hintergrund klimatischer Veränderungen noch sinnvoll, in räumlicher Nähe zum Eingriff z. B. Steinhaufen für Zauneidechsen (Lacerta agilis) und Mauereidechsen (Podarcis muralis)
als Ersatzhabitat anzulegen, vor allem, da der längerfristige Nutzen dieser Maßnahmen nicht mehr gesichert ist? Derartige Mittel könnten evtl. besser in einen Naturschutzfonds gezahlt werden (ähnlich wie in Bayern), der Maßnahmen und Konzepte (vgl. Abschnitt 3) finanziert.
Bspw. besteht gerade in Ballungsräumen mit einem dichten Netz von Infrastrukturtrassen (Straße, Schiene) meist ein akuter Mangel an Flächen, die für Kompensationsmaßnahmen geeignet sind. Vor diesem Hintergrund kommt es z. B. in Süddeutschland regelmäßig zu
artenschutzrechtlichen Konflikten hinsichtlich Zaun- und Mauereidechsen, wobei letztere vielfach keine autochthonen Populationen oder Hybridpopulationen darstellen (vgl. auch LfU 2021). Bei sehr vielen Vorhaben handelt es sich um Sanierungen von
Brücken o. ä., bei denen nur eine temporäre Inanspruchnahme der Lebensräume besteht und im Anschluss eine erneute Besiedlung der zuvor als Lebensraum genutzten Böschungen absehbar ist.
In Hinblick auf eine Flexibilisierung des aus der FFH-RL und VS-RL resultierenden Artenschutzes können sich daraus u. a. folgende an den Klimawandel angepasste Strategien und Maßnahmen ergeben:
Identifikation eindeutiger Klimagewinner (vgl. Schlumprecht et al. 2010; Fartmann et al. 2012). Zahlreiche Beispiele enormer, vom Naturschutz nicht erwarteter Ausbreitungsleistungen
überwiegend – aber nicht nur – wärmeliebender Arten über alle Organismengruppen hinweg zeigen, dass eine mangelnde Neu- oder Wiederbesiedlung geeigneter Habitate nicht an fehlenden Biotopverbünden, fehlenden Ausbreitungsvektoren etc. gelegen hat. Dies gilt auch für Arten
der FFH-RL und kann bedeuten, Arten der FFH-Anhänge – z. B. Nachtkerzenschwärmer (Proserpinus proserpina), Mauereidechse, Russischer Bär (Euplagia quadripunctaria) – bei Kompensationen im Rahmen der Eingriffsregelung und „Abschichtungs“-Prozessen im
Rahmen einer speziellen artenschutzrechtlichen Prüfung (saP) nicht mehr voll umfänglich zu berücksichtigen. So wäre es z. B. denkbar, bei Instandsetzungen von Infrastruktur lediglich den Tötungstatbestand gem. § 44 (1) Nr. 1 BNatSchG zu vermeiden und auf die
Herstellung neuer Fortpflanzungs- und Ruhestätten dieser Arten zu verzichten, da innerhalb weniger Jahre eine natürliche Wiederbesiedlung der in Anspruch genommenen Habitate möglich ist. In letzter Konsequenz sollte bei diesen Arten darüber diskutiert werden, ob sie aus den Anhängen der
FFH-RL und aus dem strengen Artenschutz entlassen werden können.
5 Fazit
Die FFH-RL hat sich insbesondere seit der Novellierung des BNatSchG 2010 als wirksames Instrument des Naturschutzes gezeigt. Angesichts drastischer, durch den Klimawandel nochmal verschärfter Umweltveränderungen ergibt sich jedoch ein steigender Flexibilisierungsbedarf der FFH-RL
und anderer zur Umsetzung von Natura 2000 nötiger Naturschutzinstrumente (z. B. Kulturlandschaftsprogramme, Vertragsnaturschutz). Im Zentrum einer nötigen Flexibilisierung stehen dabei unserer Ansicht nach die folgenden vier Anpassungen vor allem an klimatische
Veränderungen. Ein Teil dieser Vorschläge ist schon evidenzbasiert, d. h. es liegt gesichertes Wissen zu ihrer Wirksamkeit vor allem aus der ökologischen Forschung vor; es muss nur angewendet werden (1 und 4). Die anderen Anpassungsvorschläge sind überwiegend
hypothesenbasiert, sodass dort noch Forschungsbedarf besteht (2 und 3):
6 Literatur
↑
Adelmann J., Blanckenhagen B. von (2021): Im Fokus: Kleine Moosjungfer (Leucorrhinia dubia) und Schwarze Heidelibelle (Sympetrum danae) – eine Analyse der Verbreitung zweier „klimasensibler Arten“ in Hessen (Odonata: Libellulidae).
Libellen in Hessen 14: 77 – 93.
↑
Altmoos M., Burkhardt R. (2016): Netzwerk Natura 2000 – Plädoyer für eine dynamische Sichtweise. Natur und Landschaft 91(6): 272 – 279.
↑
Bässler C., Hothorn T. et al. (2013): Insects overshoot the expected upslope shift caused by climate warming. PLOS ONE 8(6): e65842. DOI:
10.1371/journal.pone.0065842
↑
BfN, BLAK/Bundesamt für Naturschutz, Bund-Länder-Arbeitskreis FFH-Monitoring und Berichtspflichten (Hrsg.) (2017a):
Bewertungsschemata für die Bewertung des Erhaltungsgrades von Arten und Lebensraumtypen als Grundlage für ein bundesweites FFH-Monitoring. Teil I: Arten nach Anhang II und IV der FFH-Richtlinie (mit Ausnahme der marinen Säugetiere). BfN-Skripten 480:
374 S.
↑
BfN, BLAK/Bundesamt für Naturschutz, Bund-Länder-Arbeitskreis FFH-Monitoring und Berichtspflichten (Hrsg.) (2017b):
Bewertungsschemata für die Bewertung des Erhaltungsgrades von Arten und Lebensraumtypen als Grundlage für ein bundesweites FFH-Monitoring. Teil II: Lebensraumtypen nach Anhang I der FFH-Richtlinie (mit Ausnahme der marinen und Küstenlebensräume). BfN-Skripten 481:
242 S.
↑
Bittner T., Jaeschke A. et al. (2011): Comparing modelling approaches at two levels of biological organisation – Climate change impacts on
selected Natura 2000 habitats. Journal of Vegetation Science 22(4): 699 – 710.
↑
Bluth T., Erber K. et al. (2020): Ganzjährige Großkoppel-Beweidung: Auswirkungen auf Populationen der
Wiesenknopf-Ameisenbläulinge Phengaris nausithous und Phengaris teleius. Naturschutz und Landschaftsplanung 52(12): 548 – 590.
↑
Brunzel S. (2011): Artenhilfsprogramm für den Feldenzian (Gentianella campestris) in Hessen. Abschlussbericht. Institut für Biodiversitätsmanagment. Marburg: 21 S.
↑
Brunzel S. (2012): Der Feldenzian (Gentianella campestris) in Hessen und angrenzenden Bundesländern – Ökologie und Gefährdung. Botanik und Naturschutz in Hessen 25: 41 – 54.
↑
Brunzel S., Sommer M. et al. (2017): Erhaltungskulturen zur Wiederansiedlung des
Karpaten-Enzians im Osterzgebirge. Naturschutz und Landschaftsplanung 49(1): 19 – 27.
↑
Bunzel-Drüke M., Reisinger E. (2019): Naturnahe Beweidung und Natura 2000 – Ganzjahresbeweidung im Management von Lebensraumtypen und Arten im europäischen Schutzgebietssystem Natura 2000. 2. Aufl. Arbeitsgemeinschaft
Biologischer Umweltschutz. Bad Sassendorf: 411 S.
↑
Davies Z.G., Wilson R.J. et al. (2006): Changing habitat associations of a thermally constrained species, the silverspotted skipper
butterfly, in response to climate warming. Journal of Animal Ecology 75(1): 247 – 256.
↑
Dolek M., Thamke I., Königer J. (2009): Artenhilfsprogramm Böhmischer Enzian (Gentianella bohemica). Unveröffentlichtes Gutachten im Auftrag des Bayerischen Landesamtes für Umwelt (LfU). Augsburg: 35 S.
↑
Ellwanger G., Ssymank A. (2012): Thesis and chances for the adaptation of the ecological network “Natura 2000” to climate change. In: Ellwanger G., Ssymank A., Paulsch C. (Hrsg.): Natura 2000 and climate chance – A challenge.
Naturschutz und Biologische Vielfalt 118: 7 – 28.
↑
Fartmann T., Behrens M. et al. (2012): Potential effects of climate change on the biodiversity in North Rhine-Wesphalia. In: Ellwanger G., Ssymank A., Paulsch C. (Hrsg.): Natura 2000 and climate chance – A challenge. Naturschutz und
Biologische Vielfalt 118: 63 – 72.
↑
Forister M.L., McCall A.C. et al. (2010): Compounded effects of climate change and habitat alteration shift patterns of butterfly diversity. PNAS 107(5):
2.088 – 2.092. DOI: 10.1073/pnas.0909686107
↑
Frishkoff L.O., Karp D.S. et al. (2016): Climate change and habitat conversion favour the same species. Ecology Letters 19(9):
1.081 – 1.090.
↑
Guo F.F., Lenoir J., Bonebrake T.C. (2018): Land-use change interacts with climate to determine elevational species redistribution. Nature Communications 9: 1.315. DOI:
10.1038/s41467-018-03786-9
↑
Halsch C.A., Shapiro A.M. et al. (2021): Insects and recent climate change. PNAS 118(2): e2002543117. DOI: 10.1073/pnas.2002543117
↑
Hanspach J., Kühn I., Klotz S. (2013): Risikoabschätzung für Pflanzenarten, Lebensraumtypen und ein funktionelles Merkmal. In: Vohland K., Badeck F. et al. (Hrsg.): Schutzgebiete Deutschlands im Klimawandel – Risiken und
Handlungsoptionen. Naturschutz und Biologische Vielfalt 129: 71 – 85.
↑
Hollmann V., Donath T.W. et al. (2020): From nutrients to competition processes: Habitat specific threats to Arnica montana
L. populations in Hesse, Germany. PLOS ONE 15(5): e0233709. DOI: 10.1371/journal.pone.0233709
↑
Kaule G. (1986): Arten- und Biotopschutz. Verlag Eugen Ulmer. Stuttgart: 461 S.
↑
Krüß A., Riecken U., Sukopp U. (2016): Die Ökologisierung des Arten- und Biotopschutzes – Erfolge und Grenzen einer wechselseitigen Befruchtung. Natur und Landschaft
91(9/10): 436 – 444.
↑
Laussmann T., Radtke A. et al. (2010): 150 Jahre Schmetterlingsbeobachtung in Wuppertal – Auswirkungen von Klima und Landschaftsveränderungen (Lepidoptera). Entomologische Zeitschrift 120(6): 269 – 277.
↑
LfU/Landesamt für Umweltschutz Rheinland-Pfalz (Hrsg.) (2021): Heimisch oder gebietsfremd?
Anleitung zur Bestimmung und zum Umgang mit allochthonen Mauereidechsen in Rheinland-Pfalz. LfU. Mainz: 39 S.
↑
Oliver T., Hill J.K. et al. (2009): Changes in habitat specificity of species at their climatic range boundaries. Ecology Letters 12(10):
1.091 – 1.102.
↑
Parmesan C., Yohe G. (2003): A globally coherent fingerprint of climate change impacts across natural systems. Nature 421(6.918): 37 – 42.
↑
Pateman R.M., Hill J.K. et al. (2012): Temperature-dependent alterations in host use drive rapid range expansion in a butterfly. Science 336(6.084):
1.028 – 1.030. DOI: 10.1126/science.1216980
↑
Peñuelas J., Rutishauser T., Filell I. (2009): Phenology feedbacks on climate change. Science 324(5.929): 887 – 888.
↑
Petermann J., Balzer S. et al. (2007): Klimawandel – Herausforderung für das europaweite Schutzgebietssystem Natura 2000. In: Balzer S., Dieterich M., Beinlich B. (Hrsg.): Natura 2000 und Klimaänderungen. Naturschutz und Biologische
Vielfalt 46: 127 – 148.
↑
Plachter H. (1991): Naturschutz. Verlag Eugen Ulmer. Stuttgart: 463 S.
↑
Preston K.L., Rotenberry J.T. et al. (2008): Habitat shifts of endangered species under altered climate conditions: Importance of biotic interactions.
Global Change Biology 14(11): 2.501 – 2.515. DOI: 10.1111/j.1365-2486.2008.01671.x
↑
Reinhardt R., Harpke A. et al. (2020): Verbreitungsatlas der Tagfalter und Widderchen Deutschlands. Verlag Eugen Ulmer. Stuttgart: 432 S.
↑
Rumpf S.B., Hülber K. et al. (2018): Range dynamics of mountain plants decrease with elevation. PNAS 115(8): 1.848 – 1.853.
↑
Schiel F.-J., Kunz B. (2005): Zur aktuellen Bestandsentwicklung von Lestes barbarus, Aeshna affinis und Sympetrum meridionale in zwei Regionen Baden-Württembergs (Odonata: Lestidae, Aeshnidae, Libellulidae). Libellula 24(3/4):
163 – 190.
↑
Schlumprecht H., Bittner T. et al. (2010): Möglichkeiten zur
Gefährdungseinschätzung der FFH-Tierarten Deutschlands angesichts des Klimawandels. Naturschutz und Landschaftsplanung 42(10): 293 – 303.
↑
Schwenkmezger L. (2019): Auswirkungen des Klimawandels auf hessische Arten und Lebensräume. Liste
potentieller Klimaverlierer. Hessisches Landesamt für Naturschutz, Umwelt und Geologie (HLNUG). Wiesbaden: 54 S.
↑
Seibold S., Gossner M.M. et al. (2019): Arthropod decline in grasslands and forests is associated with landscape-level drivers. Nature 574(7.780):
671 – 674.
↑
Settele J., Kudrna O. et al. (2008): Climatic risk atlas of European butterflies. Pensoft. Sofia: 710 S.
↑
Stanik N., Hollmann V. et al. (2018): Die Arnika (Arnica montana L.): Erfahrungen und vorläufige Ergebnisse aus Praxis und Forschung zu Rückgang, Hilfsmaßnahmen und Managementperspektiven für eine
Verantwortungsart unseres Berggrünlandes. Jahrbuch Naturschutz in Hessen 17: 99 – 104.
↑
Steger J. (2021): Modelling potential regional distribution of rare species in Hesse. Dissertation. Philipps-Universität Marburg. Marburg: 114 S.
↑
Streitberger M., Ackermann W. et al. (2016): Artenschutz unter Klimawandel: Perspektiven für ein zukunftsfähiges Handlungskonzept. Naturschutz und Biologische Vielfalt 147: 368 S.
↑
Titze A., Hepting C. et al. (2020): Wilde Arnika: ein Leitfaden für die Praxis. Philipps-Universität Marburg. Marburg: 229 S.
↑
Wieden M. (2003): Der 15. Juni, vom Klimawandel überholt? Langjährige Ergebnisse von Vertragsnaturschutzkontrollen im Landkreis Gießen. Vortrag auf einer Tagung des Bundesamtes für Naturschutz im Naturschutzzentrum Hessen (NZH) e. V. in
Wetzlar am 16. und 17.9.2003.
↑
Zeuss D., Brandl R. et al. (2014): Global warming favours light-coloured insects in Europe. Nature Communications 5(1): 4.874. DOI: 10.1038/ncomms4874



