Zusammenfassung
Abstract
Inhalt
1 Einleitung
Problematik von Standard-Saatmischungen für einjährige Blühstreifen
Forschungsdefizit bei einjährigen Blühmischungen
2 Material und Methoden
2.1 Untersuchungsgebiet und -design
2.2 Blütenbesuchende Insekten: Auswahl und Analysen
3 Ergebnisse
4 Diskussion
5 Empfehlungen zur ökologischen Optimierung von Blühstreifen
Förderung
1 Einleitung
Problematik von Standard-Saatmischungen für einjährige Blühstreifen
Forschungsdefizit bei einjährigen Blühmischungen
Wie lassen sich einjährige Blühstreifen aus vegetationsökologischer Sicht optimieren?
Welche Pflanzenarten fördern eine hohe Blütenbesucher-Diversität und welche Hinweise für die Saatgut-Zusammensetzung lassen sich ableiten?
Wie unterscheidet sich das Blütenbesucher-Artenspektrum zwischen Neophyten und heimischen Segetalarten?
2 Material und Methoden
2.1 Untersuchungsgebiet und -design

|
Tab. 1: Pflanzenarten der beiden Saatmischungen und spontan auf den Blühstreifen wachsende Arten, auf denen Blütenbesuche nachgewiesen wurden.
Table 1: Plant species in the two seed mixtures and species growing spontaneously on the flower strips on which flower visits were detected.
|
|||||||||||
|
Wissenschaftlicher Name
|
Deutscher Name
|
Abkürzung1
|
Familie2
|
Herkunft3
|
Ellenberg-Feuchtezahl4
|
Soziale Bienen (N/S)5
|
Solitäre Wildbienen (N/S)5
|
Schwebfliegen (N/S)5
|
Tagfalter (N/S)5
|
Nektar- und Pollenwert6
|
Blühzeit (Monate)7
|
|
Standardmischung
|
|||||||||||
|
Helianthus annuus
|
Sonnenblume
|
Hlna
|
Aste
|
N
|
K. A.
|
186/6
|
0/0
|
22/4
|
4/2
|
3/3 *
|
VII – IX
|
|
Linum usitatissimum
|
Saat-Lein
|
Lnmu
|
Lina
|
N
|
K. A.
|
18/5
|
0/0
|
0/0
|
0/0
|
1/1 *
|
VI – VII
|
|
Ornithopus sativus
|
Seradella
|
Orns
|
Faba
|
N
|
K. A.
|
111/4
|
0/0
|
0/0
|
0/0
|
2/2 *
|
VI – VIII
|
|
Phacelia tanacetifolia
|
Rainfarn-Phacelie
|
Phct
|
Bora
|
N
|
K. A.
|
551/6
|
2/1
|
2/1
|
0/0
|
4/3 *
|
VI – IX
|
|
Raphanus sativus
|
Ölrettich
|
Rsp.
|
Bras
|
N
|
K. A.
|
142/6
|
0/0
|
3/2
|
10/4
|
3/2 *
|
V – VII
|
|
Sinapis alba
|
Gelbsenf
|
Snpa
|
Bras
|
N
|
K. A.
|
5/3
|
11/7
|
0/0
|
3/2
|
2 – 3/3 *
|
VI – IX
|
|
Trifolium alexandrinum
|
Alexandrinerklee
|
Trfa
|
Faba
|
N
|
K. A.
|
60/5
|
0/0
|
0/0
|
0/0
|
1/2 *
|
VI – IX
|
|
Sondermischung
|
|||||||||||
|
Anthemis tinctoria
|
Färberkamille
|
Antt
|
Aste
|
H
|
3
|
10/3
|
2/1
|
16/3
|
4/4
|
2/2 *
|
VI – IX
|
|
Borago officinalis
|
Borretsch
|
Brgo
|
Bora
|
N
|
K. A.
|
21/4
|
0/0
|
0/0
|
0/0
|
4/2 *
|
VI – IX
|
|
Calendula officinalis
|
Ringelblume
|
Clno
|
Aste
|
N
|
K. A.
|
44/3
|
22/7
|
14/4
|
20/2
|
2/2 *
|
VI – IX
|
|
Centaurea cyanus
|
Kornblume
|
Cntc
|
Aste
|
H
|
K. A.
|
374/6
|
0/0
|
2/1
|
3/2
|
3/2 *
|
VI – IX
|
|
Coriandrum sativum
|
Koriander
|
|
N
|
K. A.
|
0/0
|
1/1
|
0/0
|
1/1
|
4/1 **
|
VI – VII ***
|
|
|
Daucus carota
|
Wilde Möhre
|
Dcsc
|
Apia
|
H
|
4
|
0/0
|
37/11
|
11/8
|
0/0
|
2/2 *
|
VI – IX
|
|
Fagopyrum esculentum
|
Buchweizen
|
Fgpe
|
Poly
|
N
|
K. A.
|
3/1
|
0/0
|
0/0
|
1/1
|
4/3 *
|
VII – IX
|
|
Glebionis segetum (
|
Saatwucherblume
|
Glbs
|
Aste
|
H
|
5
|
13/2
|
65/19
|
52/7
|
5/5
|
2/K. A. ***
|
VII – X
|
|
Helianthus annuus
|
Sonnenblume
|
Siehe oben
|
|||||||||
|
Linum usitatissimum
|
Saat-Lein
|
Siehe oben
|
|||||||||
|
Malva sylvestris
|
Wilde Malve
|
Mlvs
|
Malv
|
H
|
4
|
5/2
|
0/0
|
0/0
|
1/1
|
K. A.
|
VI – IX
|
|
Matricaria chamomilla
|
Echte Kamille
|
Mtrc
|
Aste
|
H
|
5
|
0/0
|
18/8
|
1/1
|
1/1
|
1/2 *
|
V – VIII
|
|
Medicago lupulina
|
Hopfenklee
|
|
H
|
4
|
1/1
|
0/0
|
0/0
|
0/0
|
3/1 **
|
V – X ***
|
|
|
Papaver dubium
|
Saat-Mohn
|
|
H
|
4
|
0/0
|
0/0
|
0/0
|
0/0
|
0/3 **
|
V – VI
|
|
|
Papaver rhoeas
|
Klatschmohn
|
Ppvr
|
Papa
|
H
|
5
|
21/2
|
0/0
|
0/0
|
0/0
|
0 ***/3 **
|
V – VIII
|
|
Phacelia tanacetifolia
|
Rainfarn-Phacelie
|
Siehe oben
|
|||||||||
|
Raphanus raphanistrum
|
Acker-Rettich
|
Rsp.
|
Bras
|
H
|
5
|
Siehe R. sativus
|
3/2 *
|
VI – VII
|
|||
|
Sinapis arvensis
|
Acker-Senf
|
|
H
|
K. A.
|
0/0
|
0/0
|
0/0
|
0/0
|
2/2 *
|
VI – VII
|
|
|
Trifolium incarnatum
|
Inkarnatklee
|
Trfi
|
Faba
|
N
|
K. A.
|
27/4
|
0/0
|
0/0
|
2/2
|
K. A.
|
V – VIII
|
|
Vicia sativa
|
Futterwicke
|
|
N
|
K. A.
|
1/1
|
0/0
|
0/0
|
0/0
|
3/1 *
|
VI – VIII
|
|
|
Viola arvensis
|
Acker-Stiefmütterchen
|
Vlar
|
Viol
|
H
|
K. A.
|
6/3
|
0/0
|
0/0
|
1/1
|
1/1 *
|
III – VIII
|
|
Spontan auftretende Arten
|
|||||||||||
|
Achillea millefolium
|
Schafgarbe
|
|
H
|
4
|
0/0
|
0/0
|
1/1
|
1/1
|
1/2 *
|
VI – IX
|
|
|
Anthemis arvensis
|
Acker-Hundskamille
|
|
H
|
4
|
0/0
|
1/1
|
0/0
|
0/0
|
2/2 – 3 *
|
VI – IX
|
|
|
Chenopodium album
|
Weißer Gänsefuß
|
Chna
|
Amar
|
H
|
4
|
1/1
|
0/0
|
6/1
|
1/1
|
1/2 ***
|
VII – X
|
|
Cirsium arvense (
|
Acker-Kratzdistel
|
Crsa
|
Aste
|
H
|
K. A.
|
1/1
|
0/0
|
2/1
|
1/1
|
3/2 *
|
VI – VIII
|
|
Fallopia convolvulus (
|
Windenknöterich
|
|
H
|
5
|
0/0
|
0/0
|
0/0
|
1/1
|
3/2 *
|
VII – IX
|
|
|
Persicaria maculosa
|
Floh-Knöterich
|
|
H
|
5
|
1/1
|
0/0
|
0/0
|
0/0
|
K. A.
|
K. A.
|
|
|
Pisum sativum
|
Erbse
|
|
N
|
K. A.
|
2/2
|
0/0
|
0/0
|
0/0
|
1 – 2/1 **, ***
|
V – VII
|
|
|
Scorzoneroides autumnalis (
|
Herbst-Löwenzahn
|
|
H
|
5
|
0/0
|
3/1
|
0/0
|
0/0
|
2/K. A. ***
|
VII – IX
|
|
|
Tanacetum vulgare
|
Rainfarn
|
Tncv
|
Aste
|
H
|
5
|
0/0
|
16/4
|
0/0
|
0/0
|
2/2 *
|
VII – IX
|
|
Trifolium pratense
|
Wiesenklee
|
|
H
|
5
|
1/1
|
0/0
|
0/0
|
0/0
|
3/3 *
|
VI – IX
|
|
|
2 Abkürzungen der Pflanzenfamilien: Amar = Amaranthaceae, Apia = Apiaceae, Aste = Asteraceae, Bora = Boraginaceae, Bras = Brassicaceae, Faba = Fabaceae,
Lina = Linaceae, Malv = Malvaceae, Papa = Papaveraceae, Poly = Polygonaceae, Viol = Violaceae
3 Angaben zur Herkunft: N = neophytisch, H = heimisch (nach FloraWeb 2019)
4 Ellenberg-Feuchtezahl: nach Ellenberg, Leuschner (2010)
5 Nachgewiesene Anzahl der Blütenbesucher (N) und der Arten (S) getrennt nach sozialen Bienen, solitären Wildbienen, Schwebfliegen und Tagfaltern. Blüten der Arten Raphanus sativus und R. raphanistrum wurden im Feld bei der
Dokumentation der Blütenbesuche nicht unterschieden, weshalb die Angaben für die Blütenbesuche für beide Arten zusammen gelten.
6 Die Nektar- und Pollenwerte geben Auskunft über die Qualität und Menge von Nektar und Pollen. Diese Angaben richten sich nach * Pritsch (2018) und die Werte reichen von
0 = „nichts“ bis 4 = „sehr gut“. Sie wurden ergänzt durch ** MLR (2019) und *** BiolFlor (2020), wobei die beiden letzten Quellen eine
fünfstufige Skala von „–“ bis „sehr gut“ bzw. von 1 – 5 verwenden. Um eine Vergleichbarkeit der Werte zu ermöglichen, wurden die schriftlichen Ausformulierungen in Werte von 0 – 4 übersetzt bzw. die Werte durch Abzug von 1
angepasst.
7 Wenn nicht anders angegeben, entspricht die Quelle für die Blühzeit der für die Nektar- und Pollenwerte.
K. A. = keine Angabe
|
|||||||||||
2.2 Blütenbesuchende Insekten: Auswahl und Analysen
3 Ergebnisse
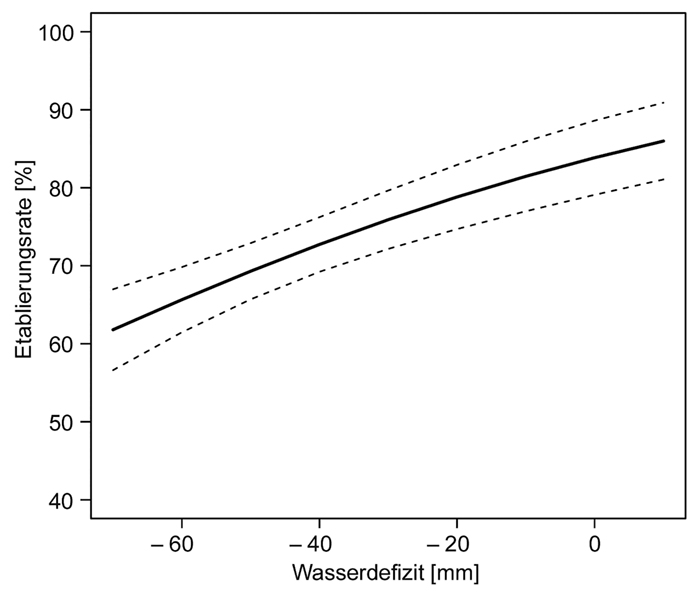
|
Tab. 2: Vergleich der in den Blühstreifen mit Standardmischung und Sondermischung in den beiden Extremjahren (Nassjahr: 2017, Trockenjahr: 2018) nachgewiesenen Gefäßpflanzenarten; Mittelwerte (MW) und Standardfehler (SF) aus jeweils sieben
Blühstreifenflächen.
Table 2: Comparison of the vascular plant species detected in the flower strips with standard seed mixture (Standardmischung) and special seed mixture (Sondermischung) in the two extreme years (wet year: 2017, dry year: 2018); mean values (MW) and standard
error (SF) from seven flower strip areas each.
|
||||||||
|
|
Sondermischung
|
|||||||
|
Untersuchungsjahr
|
2017
|
2018
|
2017
|
2018
|
||||
|
|
SF
|
MW
|
SF
|
MW
|
SF
|
MW
|
SF
|
|
|
AZ angesät total
|
7,0
|
|
|
|
||||
|
|
22,0
|
1,8
|
19,6
|
2,5
|
32,3
|
2,7
|
23,7
|
2,3
|
|
AZ angesät + etabliert
|
6,9
|
0,1
|
6,0
|
0,2
|
17,1
|
0,6
|
12,4
|
1,6
|
|
AZ spontan
|
15,1
|
1,9
|
13,6
|
2,5
|
15,1
|
2,4
|
11,3
|
1,2
|
|
Wasserdefizit [mm]
|
+ 24,9
|
|
|
|
||||
|
|
||||||||
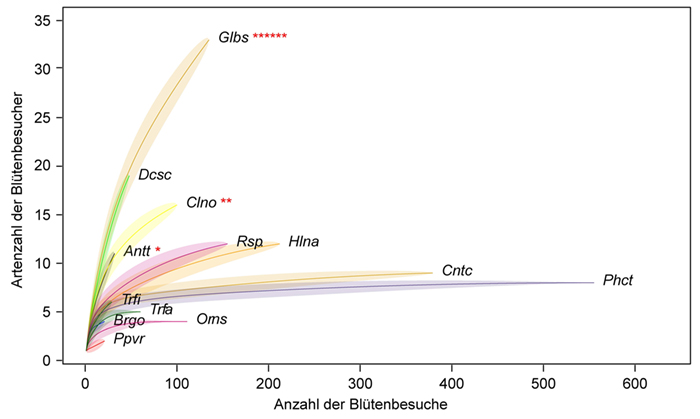
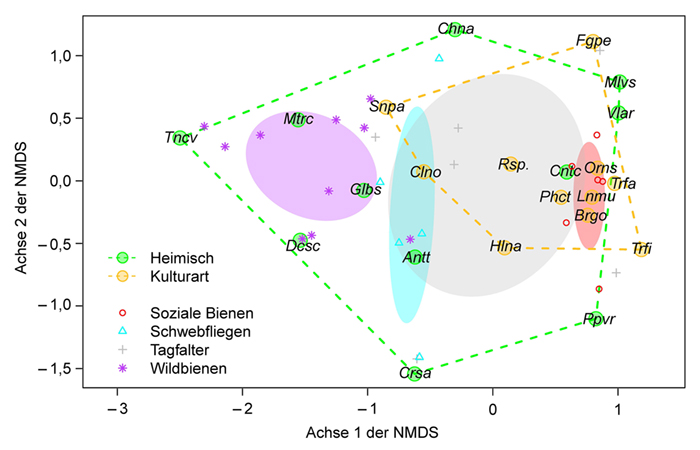
4 Diskussion
5 Empfehlungen zur ökologischen Optimierung von Blühstreifen
Möglichst regiozertifiziertes Saatgut standortangepasster Pflanzenarten unter Ausschluss von Neophyten
Saatmischungen mit mindestens 25 – 40 Arten, je nach Ausprägung der vorhandenen Samenbank
Vertreter aus allen der folgenden Pflanzenfamilien: Asteraceae, Brassicaceae, Fabaceae, Lamiaceae, Apiaceae und Campanulaceae
Hoher Anteil von Blühpflanzen mit leicht erreichbaren Nektarquellen
Bereitstellung von Blütenressourcen über die gesamte Saison
Anlage langfristig bestehender (mehrjähriger) Blühstreifen zur Schaffung eines Mosaiks verschieden alter (Blühstreifen)strukturen
Anlage angrenzend an strukturreiche Landschaftselemente (z. B. Feldraine, Hecken, Baumgruppen)
6 Literatur
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
↑

