Maria Bönisch und Imke Thormann
Zusammenfassung
Als wichtiges Argument für den Natur- und Artenschutz wird immer wieder der (potenzielle) Nutzen von Wildarten für den Menschen genannt. Das Konzept der „Wildpflanzen für Ernährung und Landwirtschaft“ (WEL), das u. a. die Erhaltung der Nutzpflanzenverwandten für die Züchtung von Kulturpflanzen zum Ziel hat, füllt genau dieses Argument mit Leben und setzt die Ziele internationaler Verträge sowie der nationalen Strategien für die (Agro-)Biodiversität um. Gut die Hälfte unserer Gefäßpflanzen sind WEL, von denen ca. 140 Arten auf Grund ihrer besonderen Bedeutung für die Landwirtschaft und ihres Gefährdungs- bzw. Schutzstatus im Naturschutz prioritär zu erhalten sind. Im Rahmen mehrerer Projekte wurden Verfahren zur Planung und Einrichtung genetischer Erhaltungsgebiete für den In-situ-Schutz erprobt; diese werden hier am Beispiel der Wildselleriearten beschrieben. In Folge dieser Aktivitäten wurde das von der Bundesanstalt für Landwirtschaft und
Ernährung koordinierte Netzwerk Genetische Erhaltungsgebiete Deutschland gegründet. Die WEL-Erhaltung ist ein positives Beispiel für die Interessensüberschneidung und mögliche Zusammenarbeit von Landwirtschaft und Naturschutz.
Wildpflanzen für Ernährung und Landwirtschaft (WEL) – genetische Ressource – genetische Vielfalt – genetisches Erhaltungsgebiet – Wildsellerie – Artenschutz – In-situ-ErhaltungAbstract
The (potential) benefit of wild species for humanity is stated repeatedly as a key argument for nature and species conservation. The concept of Crop Wild Relatives (CWR), which aims, inter alia, at the conservation of these wild relatives of our crop plants as resource for plant breeding, fills this argument with life and implements the objectives of international treaties as well as national strategies for (agro)biodiversity. Half of our vascular plants are CWR. About 140 CWR species should be conserved as a priority in nature conservation due to their special importance for agriculture and their endangerment or conservation status. Within the framework of several projects, procedures for planning and establishing genetic reserves for in situ conservation of CWR were tested and are described here using the example of wild celery species. As a result of these activities, the German Network of Genetic Reserves coordinated by the Federal Office for
Agriculture and Food (BLE) was established. CWR conservation is a positive example of the overlapping interests and possible cooperation between agriculture and nature conservation.
Crop wild relatives (CWR) – Genetic resource – Genetic diversity – Genetic reserve – Wild celery – Species protection – In situ conservationInhalt
1 Einleitung
Wildpflanzen für Ernährung und Landwirtschaft (WEL) sind mit unseren Kulturpflanzen verwandte oder potenziell für Ernährung und Landwirtschaft nutzbare Wildarten. Viele davon sind nicht nur Bestandteile unserer Ökosysteme, sondern erbringen auch eine wichtige Ökosystemdienstleistung: Sie haben eine enorme Bedeutung für die Entwicklung einer ökologisch, sozial und ökonomisch verantwortbaren Pflanzenproduktion (Dempewolf et al. 2017). Zahlreiche Arten, die gefährdet sind oder für die Deutschland eine besondere Verantwortung hat und die deshalb im Fokus des botanischen Artenschutzes stehen, sind auch WEL-Arten, z. B. der Kriechende Sellerie (Helosciadium repens), Arnika (Arnica montana) oder die Europäische Wildrebe (Vitis gmelinii). Sie sind auf Grund ihrer relativ engen verwandtschaftlichen Beziehung zu den Nutzpflanzen eine genetische Ressource für die Pflanzenzüchtung und ermöglichen
z. B. die Weiterentwicklung von Kulturarten in Hinblick auf Trockentoleranz oder Krankheitsresistenz (Dempewolf et al. 2017). So weisen z. B. einige Exemplare der Europäischen Wildrebe, die die Stammform der Kulturrebe ist, Toleranzen gegen Falschen Mehltau, Echten Mehltau oder Schwarzfäule auf (Tisch et al. 2013).
Die Erhaltung von Wildpflanzenarten ist in situ, d. h. an deren natürlichen Standorten, anzustreben. Nur so kann die innerartliche Vielfalt umfassend bewahrt werden und nur dort können Wildpflanzenpopulationen sich an wandelnde Umweltbedingungen anpassen (Maxted et al. 1997). Sie stehen so auch in Zukunft als Ressource für neue Anpassungserfordernisse zur Verfügung. Die In-situ-Erhaltung ist eine Kernaufgabe des Naturschutzes. Die In-situ-Erhaltung von WEL liegt insbesondere durch deren Bedeutung für die Pflanzenzüchtung und Ernährungssicherung auch sehr stark im Interesse des landwirtschaftlichen Sektors.
Die Erhaltung der innerartlichen Vielfalt von WEL ist bislang weder durch In-situ-Erhaltung noch durch Ex-situ-Sammlungen in Genbanken und botanischen Gärten ausreichend gesichert. Eine vom gemeinsamen Interesse des Naturschutzes und der Landwirtschaft an den WEL getragene verstärkte Zusammenarbeit birgt ein erhebliches Potenzial zur Verbesserung der Situation von WEL.
Eine Verpflichtung zur Erhaltung von WEL geht aus internationalen Verträgen wie dem Übereinkommen über die biologische Vielfalt (Convention on Biological Diversity, CBD) und dem Internationalen Vertrag über pflanzengenetische Ressourcen für Ernährung und Landwirtschaft (International Treaty on Plant Genetic Resources for Food and Agriculture, ITPGRFA) hervor (Kasten 1). Im Rahmen der CBD wird zurzeit ein „post-2020 global biodiversity framework“ entwickelt, das erneut Ziele und Indikatoren für die Erhaltung der genetischen Vielfalt von WEL enthalten soll. Auch sieht das vierte der 18 prioritären Aktionsfelder des zweiten globalen Aktionsplans für pflanzengenetische Ressourcen für Ernährung und Landwirtschaft die In-situ-Erhaltung von WEL vor.
Kasten 1: Textstellen über die Verpflichtung zur Erhaltung verwandter Wildarten im Internationalen Vertrag über pflanzengenetische Ressourcen für Ernährung und Landwirtschaft (International Treaty on Plant Genetic Resources for Food and Agriculture, ITPGRFA) und im Übereinkommen über die biologische Vielfalt (Convention on Biological Diversity, CBD).
Box 1: Text passages in the International Treaty on Plant Genetic Resources for Food and Agriculture (ITPGRFA) and the Convention on Biological Diversity (CBD) regarding the obligation to conserve crop wild relatives.
ITPGRFA
Artikel 5.1: Nach Maßgabe der innerstaatlichen Rechtsvorschriften und gegebenenfalls in Zusammenarbeit mit anderen Vertragsparteien fördert jede Vertragspartei einen integrierten Ansatz zur Erforschung, Erhaltung und nachhaltigen Nutzung pflanzengenetischer Ressourcen für Ernährung und Landwirtschaft und wird insbesondere, sofern angebracht, …
d) die In-situ-Erhaltung von verwandten Wildarten der Kulturpflanzen und von Wildpflanzen für die Nahrungsmittelerzeugung – auch in Schutzgebieten – fördern und zwar durch Unterstützung unter anderem der Bemühungen eingeborener und ortsansässiger Gemeinschaften; …
CBD
Kernziel 13 des Strategischen Plans 2011 – 2020: Bis 2020 ist die genetische Vielfalt der Nutzpflanzen und der landwirtschaftlichen Nutztiere und ihrer wilden Artverwandten, einschließlich anderer sozioökonomisch sowie kulturell wertvoller Arten, gesichert und sind Strategien zur größtmöglichen Begrenzung der genetischen Verarmung und zur Bewahrung der genetischen Vielfalt entwickelt und umgesetzt worden.
Ziel 9 der Globalen Strategie zur Erhaltung der Pflanzen (GSPC) 2011 – 2020: Bis 2020 sollen 70 % der genetischen Vielfalt der Kulturarten, ihrer verwandten Wildarten und anderer sozioökonomisch besonders wertvoller Pflanzenarten, einschließlich des damit verbundenen indigenen und lokalen Wissens, erhalten werden.
Um diesen Verpflichtungen nachzukommen und die Erhaltung der WEL, von denen ein Viertel in Deutschland in unterschiedlichem Maße gefährdet ist (Metzing 2020), zu verbessern, fördert das Bundesministerium für Ernährung und Landwirtschaft (BMEL) Aktivitäten, die in Deutschland zur In-situ-Erhaltung der WEL beitragen. Diese Aktivitäten werden nachfolgend beschrieben.
2 Definition der mit Kulturpflanzen verwandten Wildarten
Eine einfache, weitgefasste Definition der mit Kulturpflanzen verwandten Wildarten basiert auf der botanischen Gattung der Kulturpflanze. Demnach gelten alle Wildarten in derselben Gattung der Kulturpflanze als mit dieser verwandt. Die Wildarten in der Gattung Beta z. B. werden dieser Definition entsprechend als verwandte Wildarten der Kulturrübe (Beta vulgaris subsp. vulgaris) betrachtet.
Maxted et al. (2006) schlugen eine Arbeitsdefinition für WEL vor, die eine Priorisierung von WEL-Arten für die Erhaltung unterstützt. Diese Definition basiert auf dem Konzept des Genpools (GP) oder – bei Mangel an Informationen zu Kreuzungsmöglichkeiten und genetischen Ähnlichkeiten der Taxa – auf dem Konzept der Taxongruppe (TG) und lautet: Eine mit einer Kulturpflanze verwandte Wildart ist ein Taxon mit einer indirekten Nutzung auf Grund seiner relativ engen genetischen Beziehung zur Kulturpflanze. Diese Beziehung wird durch die verwandten Wildarten definiert, die zu GP-1 oder 2 bzw. TG-1 bis 4 der Nutzpflanze gehören.
Im GP-Konzept nach Harlan, de Wet (1971) werden Arten je nach Ausprägung der Kreuzungsbarrieren für konventionelle Züchtungsmethoden einem von drei GP zugeordnet. Liegen keine Kenntnisse über Kreuzungsbarrieren vor, kann man sich dem Verwandtschaftsgrad durch die taxonomische Hierarchie annähern und die Arten TG zuordnen (Maxted et al. 2006). GP und TG sind in Tab. 1 erläutert. Das GP-Konzept ist am Beispiel der Kulturrübe in Abb. 1 dargestellt.
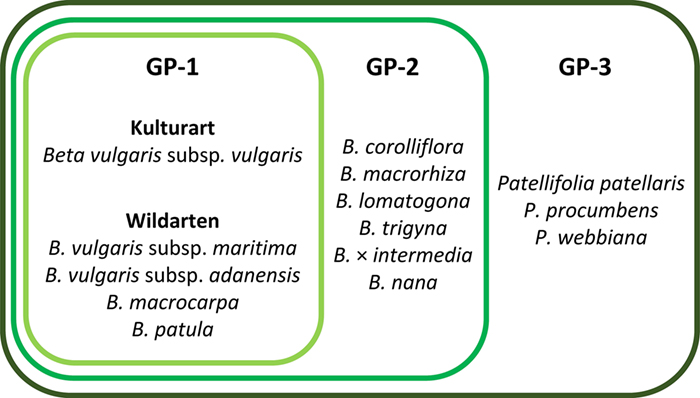
Abb. 1: Genpool der Kulturrübe (nach Frese 2014). Einteilung der Kulturart Beta vulgaris subsp. vulgaris und ihrer verwandten Wildarten der Gattungen Beta und Patellifolia (früher Gattung Beta) in den primären (GP-1), sekundären (GP-2) und tertiären (GP-3) Genpool.
Fig. 1: Genepool of cultivated beet (based on
Frese 2014). Classification of cultivated beet
Beta vulgaris subsp.
vulgaris and its wild relatives of the genera
Beta and
Patellifolia (formerly genus
Beta) into the primary (GP-1), secondary (GP-2) and tertiary (GP-3) genepool.
|
|
|
Genpool (GP)
|
Beschreibung
|
|
GP-1
|
Kulturart, Wildformen der Kulturart und Arten ohne oder mit sehr schwachen Kreuzungsbarrieren zur Kulturart
|
|
GP-2
|
Arten mit ausgeprägten Kreuzungsbarrieren zur Kulturart
|
|
GP-3
|
Überwindung von Kreuzungsbarrieren zwischen GP-3-Arten und der Kulturart nicht möglich, es sei denn mit biotechnologischen Verfahren
|
|
Taxongruppe (TG)
|
Beschreibung
|
|
TG-1a
|
Kulturpflanze
|
|
TG-1b
|
Dieselbe Art wie die Kulturpflanze
|
|
TG-2
|
Dieselbe Serie oder Sektion wie die Kulturpflanze
|
|
TG-3
|
Dieselbe Untergattung wie die Kulturpflanze
|
|
TG-4
|
Dieselbe Gattung wie die Kulturpflanze
|
|
TG-5
|
Dieselbe Tribus wie die Kulturpflanze
|
3 WEL-Arten in Deutschland
Von den 3 651 in Deutschland vorkommenden Taxa (ohne Neophyten) sind 2 472 (67,7 %) als WEL eingestuft. 69,6 % der Verantwortungsarten Deutschlands sind WEL. 31 % der durch die Fauna-Flora-Habitat-Richtlinie und 48,2 % der durch das Bundesnaturschutzgesetz (BNatSchG) streng geschützten Arten sind WEL. Etwa 26,7 % der WEL sind in unterschiedlich starkem Ausmaß gefährdet (Metzing et al. 2018; Tab. 2). Dies entspricht 60 % aller in Deutschland gefährdeten Wildpflanzenarten.
|
Tab. 2: Übersicht über Anzahl an Wildpflanzenarten, WEL-Arten und prioritären WEL-Arten mit besonderer Relevanz im Naturschutz. BNatSchG = Bundesnaturschutzgesetz, WEL = Wildpflanzen für Ernährung und Landwirtschaft.
Table 2: Overview of the number of wild species, crop wild relative (CWR) species and priority CWR species of vascular plants of particular conservation relevance. BNatSchG = Bundesnaturschutzgesetz (Federal Nature Conservation Act), WEL = Wildpflanzen für Ernährung und Landwirtschaft (crop wild relatives).
|
|
Maßnahme/Gruppe
|
Arten insgesamt
|
Davon WEL
|
Davon prioritäre WEL
|
|
|
4 062
|
2 772
|
126
|
|
|
3 651
|
2 472
|
118
|
Rote Liste der Farn- und Blütenpflanzen 2018 (ohne Neophyten, Kategorien 0, 1, 2, 3, G) ( Metzing et al. 2018) |
1 095
|
659
|
28
|
|
|
600
|
453
|
30
|
|
Im Bundesprogramm Biologische Vielfalt förderfähige Verantwortungsarten
|
92
|
64
|
22
|
|
Anhänge II, IV, V der Fauna-Flora-Habitat-Richtlinie EG 2013/17
|
42
|
13
|
3
|
|
Streng geschützte heimische Pflanzen gemäß § 7 Abs. 2 Nr. 7 und 14 BNatSchG
|
54
|
26
|
4
|
Nicht für sämtliche WEL können Erhaltungsmaßnahmen im Rahmen der aktuell vorhandenen Ressourcen durchgeführt werden. Es ist eine Priorisierung für Erhaltungsmaßnahmen auf nationaler Ebene geboten. Das Informations- und Koordinationszentrum für Biologische Vielfalt (IBV) der Bundesanstalt für Landwirtschaft und Ernährung (BLE) hat daher eine vorläufige Liste prioritärer WEL als Grundlage und Referenz für In-situ-Erhaltungsaktivitäten in Deutschland erstellt. Dies erfolgte in Zusammenarbeit mit dem Beratungs- und Koordinierungsausschuss für genetische Ressourcen landwirtschaftlicher und gartenbaulicher Kulturpflanzen (BEKO) des BMEL und durch Beratung mit Expertinnen und Experten aus der Pflanzenzüchtung und dem Bundesamt für Naturschutz (BfN). Die Liste wird auf der Basis neuer Erkenntnisse fortlaufend aktualisiert. Sie enthält 41 Arten mit hoher Priorität und 77 Arten mit einfacher Priorität (Stand 7/2019; https://bit.ly/35VDWzD, aufgerufen am 10.11.2020).
4 Umsetzung des WEL-Artenschutzes in Deutschland
Den nationalen Rahmen zur Erhaltung von WEL setzen die Nationale Strategie zur biologischen Vielfalt (NBS) des Bundesumweltministeriums (BMU 2007) und die Agrobiodiversitätsstrategie des BMEL (BMELV 2007). Gemäß NBS ist die Vielfalt heimischer Wildformen und verwandter Wildarten von Nutzpflanzen und Nutztieren durch Maßnahmen des Naturschutzes in und außerhalb von Schutzgebieten (in situ) zu sichern. Die Ziele der Agrobiodiversitätsstrategie des BMEL bilden die Grundlage für das Nationale Fachprogramm zur Erhaltung und nachhaltigen Nutzung pflanzengenetischer Ressourcen landwirtschaftlicher und gartenbaulicher Kulturpflanzen (Fachprogramm PGR) (BMELV 2015). Das Fachprogramm PGR benennt Handlungsbedarfe zur In-situ-Erhaltung von WEL. Dazu gehört die Etablierung genetischer Erhaltungsgebiete (GenEG), um den Erhaltungszustand von in
Deutschland als besonders wichtig eingestuften WEL-Arten zu verbessern.
Ein GenEG ist definiert als Fläche, die für aktive und dauerhafte Erhaltungsmaßnahmen ausgewiesen wird und auf der Management und Monitoring der genetischen Vielfalt natürlich vorkommender Wildpflanzenpopulationen erfolgen (Frese 2014; Maxted et al. 1997, 2015). Zweck eines GenEG ist die Sicherung der innerartlichen genetischen Vielfalt. Für den Schutz einer repräsentativen Stichprobe der innerartlichen Vielfalt ist deshalb ein Netzwerk verteilter GenEG notwendig, das mit den räumlichen Verteilungsmustern genetischer Vielfalt übereinstimmt. Zum Aufbau eines Netzwerks von GenEG kann der GP-Ansatz oder der floristische Ansatz gewählt werden (Maxted et al. 2015). Während sich ersterer auf die Auswahl einer einzelnen Zielart oder die Zielarten eines einzelnen Kulturart-GP
konzentriert (wie im Folgenden für den Wildsellerie-GP beschrieben), konzentriert sich Letzterer auf die Identifizierung von Hotspots prioritärer WEL-Populationen in einem bestimmten Gebiet.
BMEL und BLE richteten 2019 das nationale Netzwerk Genetische Erhaltungsgebiete Deutschland ein, mit dem eine Rahmenstruktur geschaffen wurde, in der bestehende und zukünftige WEL-Erhaltungsmaßnahmen integriert und koordiniert werden können. Das Gesamtnetzwerk besteht aus spezifischen Netzwerken für prioritäre WEL-Arten oder Artengemeinschaften. Die spezifischen Netzwerke bestehen aus GenEG für Populationen, die basierend auf vereinbarten artspezifischen, geographischen und/oder Managementkriterien ausgewählt werden (Abb. 2).
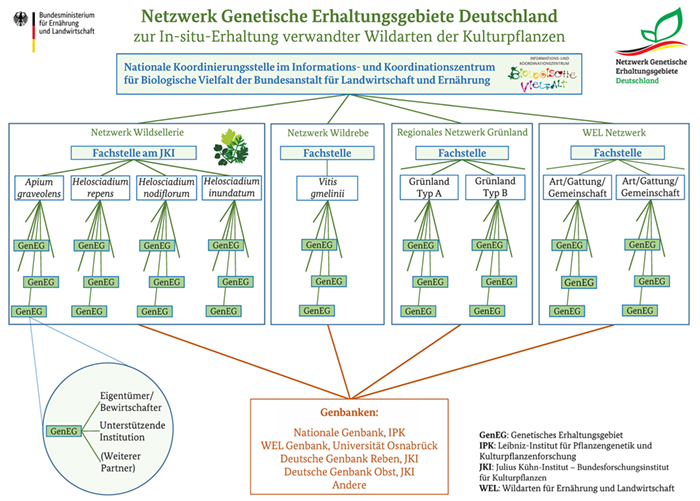
Abb. 2: Struktur des Netzwerks Genetische Erhaltungsgebiete Deutschland (Stand: Februar 2020). Die Daten über genetische Erhaltungsgebiete werden im Nationalen Inventar Pflanzengenetischer Ressourcen in Deutschland (PGRDEU) veröffentlicht (https://pgrdeu.genres.de).
Fig. 2: Structure of the German Network of Genetic Reserves in Germany (as of February 2020). The data about genetic reserves will be published in the National Plant Genetic Resources Inventory (PGRDEU) (
https://pgrdeu.genres.de).
Die Einrichtung von GenEG basiert auf freiwilliger Zusammenarbeit. Die bislang in Deutschland entwickelte Vorgehensweise sieht vor, dass
● die Eigentümerin/der Eigentümer und ggf. die Bewirtschafterin/der Bewirtschafter mindestens eines Flurstücks der Wuchsfläche der WEL-Population eine Einverständniserklärung unterzeichnet, die das Betreten der Flächen für das Management des GenEG sowie die Sammlung, Einlagerung und Abgabe von Saatgut gestattet, und
● eine lokale und dauerhafte Institution erklärt, dass sie das Management des GenEG im Rahmen der Möglichkeiten unterstützt.
Unterstützende Akteure erhalten in Anerkennung ihres Engagements eine Urkunde der BLE. Für den Aufbau eines GenEG-Netzwerks ist zudem die Einrichtung einer Fachstelle bei einer Institution erforderlich, die das Netzwerk koordiniert. Sie vernetzt Institutionen und lokale Akteure zur Erhaltung der Zielpopulationen und zur Erweiterung des Netzwerks und bildet die Schnittstelle zum Netzwerk Genetische Erhaltungsgebiete Deutschland. Das Gesamtnetzwerk wird vom IBV der BLE koordiniert.
Sammlung und Einlagerung von Saatgut als Rückstellmuster in einer Genbank dienen zur komplementären Ex-situ-Erhaltung und Bereitstellung der genetischen Ressourcen für Artenschutz, Forschung und Pflanzenzüchtung. Ein GenEG ist keine rechtlich bindende Schutzgebietskategorie, sondern stellt ein zusätzliches Prädikat, eine Auszeichnung eines Areals dar. Damit kann auf besondere WEL-Vorkommen hingewiesen werden und können entsprechende Schutzmaßnahmen in diesem Areal befördert werden.
Als erstes Teilnetzwerk wurde 2019 das Netzwerk Genetische Erhaltungsgebiete für Wildsellerie (kurz: Netzwerk Wildsellerie) gegründet, das im Folgenden beschrieben wird.
5 Netzwerk Wildsellerie
Der modellhafte Aufbau eines bundesweiten Netzwerks von GenEG für die vier in Deutschland vorkommenden Wildselleriearten war Ziel des vom BMEL geförderten Modell- und Demonstrationsvorhabens (MuD) „Genetische Erhaltungsgebiete für Wildselleriearten (Apium und Helosciadium) als Bestandteil eines Netzwerks genetischer Erhaltungsgebiete in Deutschland (GE-Sell)“ (Laufzeit: 3/2015 – 11/2019, BLE-FKZ 2814BM110–112). Die Wildselleriearten zählen zum GP des Kulturselleries (Knollen-, Blatt- oder Stangensellerie) und sind mit ihm mehr oder weniger gut kreuzbar. Sie sind entsprechend der Roten Liste Deutschlands gefährdet bzw. stark gefährdet (Metzing et al. 2018). A. graveolens subsp. graveolens (Echter Sellerie) ist die Urform des Kulturselleries und wird somit dem primären GP des Kulturselleries zugeordnet. A. graveolens kann auf Grund seiner uneingeschränkten Kreuzbarkeit
mit dem Kultursellerie insbesondere zur Verbreiterung der genetischen Basis des Kulturselleries genutzt werden. Die anderen drei Wildselleriearten H. repens (Kriechender Sumpfschirm), H. nodiflorum (Knotenblütiger Sumpfschirm) und H. inundatum (Flutender Sumpfschirm) werden dem tertiären GP zugeordnet (Downie et al. 2000; Frese et al. 2018a; Quiros 1993; Ronse et al. 2010). Die vier Arten kommen an lichten, feuchten bis nassen Standorten vor, sind konkurrenzschwach und auf Habitatstörungen angewiesen.
Für die Identifikation geeigneter Wildsellerievorkommen und zur Einrichtung der GenEG wurde ein Acht-Schritte-Verfahren (Abb. 3) erarbeitet: Die Identifikation von Wildsellerievorkommen, mit denen die innerartliche Vielfalt repräsentativ erhalten werden kann, begann mit der Zusammenstellung punktgenauer Funddaten zu den Zielarten durch Datenanfragen bei Umweltbehörden (Schritt 1). Zur Erstellung einer Inventarliste wurden die bereitgestellten Datensätze harmonisiert und ggf. bereinigt (Schritt 2). Die Inventarliste war Grundlage für die Auswahl von für GenEG geeigneten Vorkommen. Bei GE-Sell lagen auf Basis der überlieferten Informationen 2 400 Datensätze zu Wildselleriefunden vor. Aus diesen wurden 322 Fundorte mit aktuellem und lagegenauem Artnachweis ausgewählt, die zusammen unterschiedliche Naturräume abdecken und somit verschiedene genetische Adaptionen an
unterschiedliche ökogeographische Bedingungen repräsentieren können. Dadurch sollte die geographische Verteilung innerartlicher Vielfalt bei der Auswahl berücksichtigt werden.
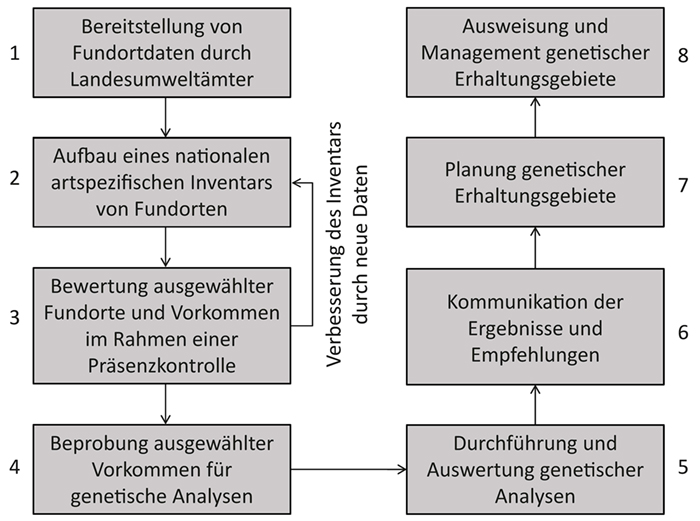
Abb. 3: Das Acht-Schritte-Verfahren zur Identifikation und Einrichtung genetischer Erhaltungsgebiete für Wildselleriearten.
Fig. 3: The eight-step procedure for identifying and establishing genetic reserves for wild celery species.
(Quelle: Frese et al. 2018a) (Source: Frese et al. 2018a)
Die Einschätzung der Eignung von Fundorten als GenEG erfolgte durch Flächenbegutachtungen und anhand von Kriterien in Anlehnung an die Mindestqualitätsstandards für GenEG nach Iriondo et al. (2012) (Schritt 3). Bei GE-Sell wurden besonders bestandsstarke Vorkommen ohne akute Gefährdung und mit bereits günstiger Bewirtschaftung bzw. Pflege als geeignet bewertet, weil bei ihnen von einem geringen Extinktionsrisiko und hohen Potenzial zur evolutiven Anpassung auszugehen ist. Bei 217 der 312 tatsächlich aufgesuchten Fundorte wurde eine der vier Wildselleriearten bestätigt. Rund 25 Vorkommen je Art, die möglichst in unterschiedlichen Naturräumen und Habitattypen vorkommen, wurden als geeignet bewertet und für weitere Untersuchungen ausgewählt.
Von den gewählten Vorkommen wurden Blattproben für genetische Analysen gesammelt (Schritt 4). Auf Grundlage der Analyseergebnisse wurden Vorkommen identifiziert, die zusammen die genetische Vielfalt einer Art repräsentieren (Schritt 5). Bei GE-Sell wurden für die Analysen Mikrosatellitenmarker verwendet, die sich für populationsgenetische Analysen eignen, da sie schnell evolvieren. Die Diversitätsanalyse erfolgte mit dem Distanzmaß Δ (Gregorius et al. 2003) unter Nutzung der Software DifferInt® (Gillet 2013). Δ zeigt an, in welchem Maß sich Vorkommen einer Art in ihrer genetischen Zusammensetzung voneinander unterscheiden. Die Auswertung ergab, dass die Vorkommen je Wildsellerieart untereinander im Mittel keine starke Differenzierung aufweisen. Aus diesem Grund wurden lediglich zwei Vorkommen je Art anhand der
Analyseergebnisse für die Einrichtung von GenEG ausgewählt (Frese et al. 2018b; Herden et al. 2020):
● das Vorkommen, das die Gesamtheit der anderen Vorkommen einer Art und deren genetische Zusammensetzung am besten repräsentiert, und
● das Vorkommen, das in seiner genetischen Zusammensetzung am stärksten von der aggregierten Gesamtheit der anderen Artvorkommen abweicht, was als genetische Anpassung an spezifische Umwelteinflüsse interpretiert wird.
Die bei GE-Sell demnach ausgewählten Vorkommen wurden unter Berücksichtigung der bei Schritt 3 angewendeten Kriterien um weitere Vorkommen ergänzt. Dabei wurden solche Vorkommen bevorzugt ausgewählt, bei denen lokale Akteure die Einrichtung von GenEG und das Management unterstützen oder die sich bereits in einem Schutzgebiet befinden. Insgesamt wurde für 15 Vorkommen von Apium graveolens und Helosciadium nodiflorum, 14 von H. repens und 11 von H. inundatum die Ausweisung eines GenEG empfohlen.
Untersuchung und Auswahl von Vorkommen sollten mit den lokalen Akteuren abgestimmt werden, insbesondere mit Flächeneigentümerinnen und -eigentümern, Flächenpächterinnen und -pächtern sowie mit Naturschutzbehörden. Spätestens bei der Planung der GenEG sind alle Beteiligten über das Vorhaben zu informieren, weil Einrichtung und Management von GenEG nur im gemeinsamen Einvernehmen und mit hinreichend verfügbaren Ressourcen gelingen können (Schritt 6). Insbesondere sind Eigentums- und Nutzungsrechte sowie die landesspezifischen Naturschutzgegebenheiten und Schutzgebietsverordnungen zu berücksichtigen.
Für GenEG entwickelten Hawkes et al. (1997) ein Raummodell, das sich mit Kern-, Puffer- und Übergangszonen am Modell von Biosphärenreservaten der Organisation der Vereinten Nationen für Bildung, Wissenschaft und Kultur (UNESCO; Batisse 1986) orientiert. Es wurde an die GE-Sell-Anforderungen angepasst (Abb. 4). Demnach besteht ein GenEG aus Wuchs- und Migrationsflächen, die in einer Übergangsfläche eingebettet sind. Das GenEG wird durch das art- und ortspezifische Ausbreitungsvermögen und die Lage geeigneter Biotope begrenzt. Ziel ist, das Vorkommen auf der Wuchsfläche zu erhalten und Beeinträchtigungen am Wuchsort zu vermeiden. In der Migrationsfläche sollen Maßnahmen unterlassen werden, die die Besiedlung durch die Art behindern, und in der Übergangsfläche Maßnahmen, die den Genfluss zwischen den Vorkommen reduzieren
(Frese et al. 2017; Frese et al. 2018b).
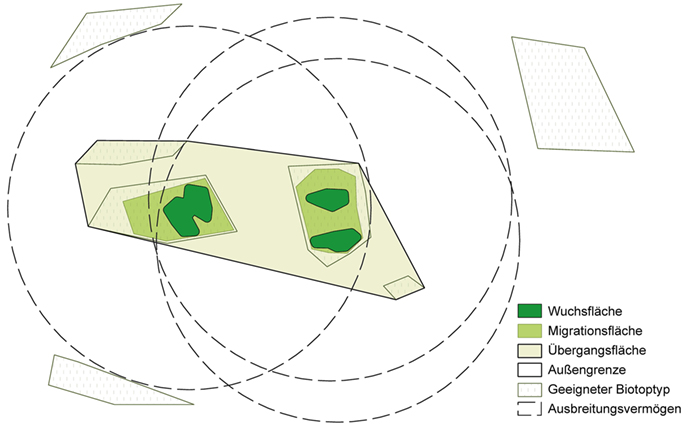
Abb. 4: Modell eines genetischen Erhaltungsgebiets für eine Zielart: Die Wuchsflächen befinden sich im Modell beispielhaft an den Standorten der drei Teilvorkommen einer Metapopulation der Zielart. Die Migrationsflächen grenzen an die Wuchsflächen an und bestehen aus Biotopen, die für Zielartvorkommen grundsätzlich geeignet sind. Sie ermöglichen dem Vorkommen, sich auf Grund räumlicher Verschiebungen von günstigen Wachstumsbedingungen umzusiedeln, bzw. gestatten eine Vergrößerung kleiner Bestände. Die Übergangsfläche verbindet die Wuchs- und Migrationsfläche mit weiteren grundsätzlich geeigneten Biotopen innerhalb der Ausbreitungsvermögen (Quellen: Frese et al. 2017; Frese et al. 2018b; verändert).
Fig. 4: Model of a genetic reserve for a target species: In the model, the growing areas are located at the sites of the three sub-occurrences of a meta-population of the target species. Migration areas are adjacent to the growing areas and consist of biotopes that are generally suitable for the target species. They allow the occurrence to relocate due to spatial shifts of favourable growth conditions, or to expand in case of small populations. The transient area connects the growing and migration area with other biotopes that are fundamentally suitable for target species within the dispersal capacity (sources:
Frese et al. 2017;
Frese et al. 2018b; modified).
Für die Planung der GenEG (Schritt 7) wurden die Wuchs-, Migrations- und Übergangsflächen verortet und anschließend standortspezifische Pflegepläne erstellt. Die Pläne sind mit den Beteiligten abzustimmen – insbesondere, weil Einrichtung und Unterstützung von GenEG auf freiwilligem Engagement der lokalen Akteure basieren. Im letzten Schritt (Schritt 8) wurden die GenEG nach Unterzeichnung der Einverständniserklärungen eingerichtet und Saatgutproben in der Genbank WEL eingelagert. Für die Koordination des GenEG-Netzwerks wurde die Fachstelle Wildsellerie am Julius Kühn-Institut eingerichtet.
Durch GE-Sell und die Fachstelle Wildsellerie wurden bis Dezember 2020 17 GenEG für Wildselleriearten eingerichtet und das erste GenEG-Netzwerk in Europa aufgebaut. Die Fachstelle strebt die Einrichtung von mindestens 28 weiteren GenEG an.
6 Anmerkungen und Ausblick
Das im Rahmen von GE-Sell entwickelte Verfahren ist für den Aufbau weiterer GenEG-Netzwerke geeignet und Grundlage des vom BMEL über die BLE geförderten MuD „In-situ-Erhaltung von Wildpflanzen für Ernährung und Landwirtschaft mittels Schirmarten (IsWEL)“ (Projektlaufzeit: 07/2020 – 12/2023, BLE-FKZ: 2819BM040–042). Basierend auf dem floristischen Lösungsansatz soll ein GenEG-Netzwerk in WEL-Hotspots aufgebaut werden. Zielarten in dem Projekt sind WEL, die als Schirmarten für weitere WEL-Arten herangezogen werden können.
Als ein weiteres Beispiel für eine gute Zusammenarbeit zwischen Landwirtschaft und Naturschutz sind die Aktivitäten zur Erhaltung der Wildrebe zu nennen. Das vom BMEL finanzierte Projekt „Überlebenssicherung der Wildrebe in den Rheinauen“ (KIT 2013; Ledesma-Krist et al. 2013) hatte das Ziel, genetisch vielfältige, anpassungs- und überlebensfähige Populationen im ursprünglichen Verbreitungsareal der Wildrebe zu erhalten bzw. wiederaufzubauen. Untersuchungen der Wildrebenvorkommen zeigten, dass diese auch ein sehr wertvolles Reservoir für eine züchterisch nutzbare Resistenz gegen Schwarzfäule darstellen (Nick 2014).
Die Erhaltung der WEL-Arten könnte forciert werden, wenn aus dem Nebeneinander von Programmen und Projekten in den jeweiligen Zuständigkeiten der Landwirtschafts- und Umweltministerien Synergien realisiert werden könnten. Als Beispiel sei hier das bundesweite Wildpflanzenschutzprojekt WIPs-De II (https://wips.deutschlandflora.de/wips-projekt) genannt. Maßnahmen des botanischen Artenschutzes werden auf die Erhaltung der Verantwortungsarten, darunter viele WEL, angewendet. Ziel ist es, Saatgut und Sporen gefährdeter Vorkommen deutschlandweit zu sammeln, sie für weitere wissenschaftliche Untersuchungen und Naturschutzmaßnahmen zu sichern, daraus in botanischen Gärten Jungpflanzen für Erhaltungskulturen heranzuziehen und diese ggf. für (Wieder)ansiedlungen zu verwenden (Lauterbach et al. 2021 in dieser Ausgabe). Eine Integration
spezifischer Aspekte der WEL-Erhaltung und -Nutzung wäre hier gut denkbar. Die gemeinsame Nutzung von Wissen und Mitteln könnte das gemeinsame Ziel – den Schutz der biologischen Vielfalt und somit auch menschlicher Lebensgrundlagen – unterstützen.
Die innerartliche Vielfalt trägt entscheidend zur Erhaltung einer Art bei und ist bei WEL-Arten zudem eine wichtige Ressource für die Züchtung. Verstärkte Bemühungen zur Erhaltung der innerartlichen genetischen Vielfalt von Wildpflanzenarten sind dringend geboten.
7 Literatur
↑
Batisse M. (1986): Developing and focusing the biosphere reserve concept. Nature and Resources 22(3): 1 – 10.
↑
BMELV/Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz (2007): Agrobiodiversität erhalten, Potenziale der Land-, Forst- und Fischereiwirtschaft erschließen und nachhaltig nutzen. BMELV. Berlin: 83 S.
↑
BMELV/Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz (2015): Nationales Fachprogramm zur Erhaltung und nachhaltigen Nutzung pflanzengenetischer Ressourcen landwirtschaftlicher und gartenbaulicher Kulturpflanzen. BMELV. Berlin: 66 S.
↑
BMU/Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit (2007): Nationale Strategie zur Biologischen Vielfalt. BMU. Berlin: 178 S.
↑
Buttler K.P., May R., Metzing D. (2018): Liste der Gefäßpflanzen Deutschlands. Florensynopse und Synonyme. BfN-Skripten 519: 286 S.
↑
Dempewolf H., Baute G. et al. (2017): Past and future use of wild relatives in crop breeding. Crop Science 57(3): 1 070 – 1 082. DOI: 10.2135/cropsci2016.10.0885
↑
Downie S.R., Watson M.F. et al. (2000): Molecular systematics of Old World Apioideae (Apiaceae): relationships among some members of tribe Peucedaneae sensu lato, the placement of several island-endemic species, and resolution within the apioid superclade. Canadian Journal of Botany 78(4): 506 – 528. DOI: 10.1139/b00-029
↑
Frese L. (2014): Erhalt der genetischen Vielfalt wildlebender Verwandter unserer Kulturarten (WVK) in ihren natürlichen Lebensräumen. ANLiegen Natur 36(2): 58 – 66.
↑
Frese L., Bönisch M., Vögel R. (2017): Entwicklung einer Strategie für die In-situ-Erhaltung wildlebender Verwandter von Kulturpflanzen (WVK). Journal für Kulturpflanzen 69(10): 339 – 350.
↑
Frese L., Bönisch M. et al. (2018a): In-situ-Erhaltung von Wildselleriearten. Naturschutz und Landschaftsplanung 50(5): 155 – 163.
↑
Frese L., Bönisch M. et al. (2018b): Patterns of genetic diversity and implications for in situ conservation of Wild Celery (Apium graveolensL. subsp. graveolens). Agriculture 8(9): 129. DOI: 10.3390/agriculture8090129
↑
Gillet E.M. (2013): DifferInt: compositional differentiation among populations at three levels of genetic integration. Molecular Ecology Resources 13(5): 953 – 964. DOI: 10.1111/1755-0998.12145
↑
Gregorius H.-R., Gillet E.M., Ziehe M. (2003): Measuring differences of trait distributions between populations. Biometrical Journal 45(8): 959 – 973. DOI: 10.1002/bimj.200390063
↑
Harlan J.R., de Wet J.M. (1971): Towards a rational classification of cultivated plants. Taxon 20(4): 509 – 517. DOI: 10.2307/1218252
↑
Hawkes J.G., Maxted N., Zohary D. (1997): Reserve design. In: Maxted N., Ford-Lloyd B.V., Hawkes J.G. (Hrsg.): Plant Genetic Conservation: The in situ approach. Springer Netherlands. Dordrecht: 132 – 143. DOI: 10.1007/978-94-009-1437-7_8
↑
Herden T., Bönisch M., Friesen N. (2020): Genetic diversity of Helosciadiumrepens (Jacq.) W.D.J. Koch (Apiaceae) in Germany, a crop wild relative of celery. Ecology and Evolution 10(2): 875 – 890. DOI: 10.1002/ece3.5947
↑
Iriondo J.M., Maxted N. et al. (2012): Quality standards for genetic reserve conservation of crop wild relatives. In: Maxted N., Dulloo E.M. et al. (Hrsg.): Agrobiodiversity conservation: securing the diversity of crop wild relatives and landraces. CABI. Wallingford: 72 – 77. DOI: 10.1079/9781845938512.0000
↑
KIT/Karlsruher Institut für Technologie (2013): Das Wildreben-Projekt.KIT. https:/www.botanik.kit.edu/garten/458.php (aufgerufen am 15.11.2020).
↑
Lauterbach D., Zippel, E. et al. (2021): Gefährdete Pflanzen erhalten – Wiederansiedlungen als Artenschutzmaßnahme. Natur und Landschaft 96(9/10): 475 – 481.
↑
Ledesma-Krist G.M., Nick P. et al. (2013): Überlebenssicherung der Wildrebe Vitis viniferaL. subsp. sylvestrisC.C. Gmel. in den Rheinauen durch gezieltes In situ-Management. Abschlussbericht 2008 – 2013. Rastatt: 94 S. + An-hänge. https://bit.ly/2ONliV2 (aufgerufen am 15.11.2020).
↑
Maxted N., Avagyan A. et al. (2015): ECPGR Concept for in situ conservation of crop wild relatives in Europe. Wild Species Conservation in Genetic Reserves Working Group, European Cooperative Programme for Plant Genetic Resources. Rom: 20 S.
↑
Maxted N., Ford-Lloyd B.V., Hawkes J.G. (Hrsg.) (1997): Plant Genetic Conservation: the in situ approach. Chapman & Hall. London: 446 S.
↑
Maxted N., Ford-Lloyd B.V. et al. (2006): Towards a definition of a crop wild relative. Biodiversity and Conservation 15(8): 2 673 – 2 685. DOI: 10.1007/s10531-005-5409-6
↑
Metzing D. (2020): Wildpflanzen für Ernährung und Landwirtschaft im botanischen Artenschutz. In: Bönisch M., Bernhardt N. (Hrsg.): Tagungsband einer Fachveranstaltung Genetische Erhaltungsgebiete für Wildpflanzen für Ernährung und Landwirtschaft – ein neues Modul zur Stärkung des Artenschutzes. Julius-Kühn-Archiv 466: 77 – 85. DOI: 10.5073/jka.2020.466.009
↑
Metzing D., Garve E. et al. (2018): Rote Liste und Gesamtartenliste der Farn- und Blütenpflanzen (Trachaeophyta) Deutschlands. Naturschutz und Biologische Vielfalt 70(7): 13 – 358.
↑
Nick P. (2014): Schützen und nützen – von der Erhaltung zur Anwendung. Fallbeispiel Europäische Wildrebe. In: Poschlod P., Borgmann P. et al. (Bearb.): Handbuch Genbank WEL. Regensburg: Hoppea, Denkschriften der Regensburgischen Botanischen Gesellschaft, Sonderband: 159 – 173.
↑
Quiros C.F. (1993): Celery Apium graveolensL. In: Kalloo G., Bergh B.O. (Hrsg.): Genetic Improvement of Vegetable Crops. Pergamon Press. Oxford: 523 – 534. DOI: 10.1016/B978-0-08-040826-2.50041-2
↑
Ronse A.C., Popper Z.A. et al. (2010): Taxonomic revision of European ApiumL. s. l.: HelosciadiumW.D.J. Koch restored. Plant Systematics and Evolution 287(1 – 2): 1 – 17. DOI: 10.1007/s00606-010-0284-3
↑
Tisch C., Nick P., Kortekamp A. (2013): Von wilden Reben lernen – Natürliche Resistenzen gegen die Schwarzfäule. Deutsches Weinbaujahrbuch 65. Ulmer. Stuttgart: 118 – 122.
Dank
Für die hervorragende Zusammenarbeit und Hilfestellungen bei GE-Sell danken wir sämtlichen Unterstützerinnen und Unterstützern der Wildsellerievorkommen, den Behörden, Naturschutzstationen und -verbänden sowie den Kartiererinnen und Kartierern, die hier nicht alle namentlich genannt werden können. Gedankt sei auch Dr. Lothar Frese und Dr. Nadine Bernhardt für ihre Unterstützung bei der Erstellung einer früheren Version der Beschreibung des GE-Sell-Projekts.
Autorenschaft
Beide Autorinnen haben das Manuskript zu gleichen Teilen erstellt. Imke Thormann fasste die Rahmenbedingungen zur Erhaltung von WEL zusammen. Maria Bönisch beschrieb die Schritte zum Aufbau des Netzwerks Wildsellerie, an deren Umsetzung sie maßgeblich mitgewirkt hat.






